AGROBIOLOGÍA - Una visión general y sus aplicaciones
CAPÍTULO 4
Principales bacterias transmitidas por alimentos, preservación y control
Luis Daniel Martínez Angulo
http://dx.doi.org/10.4322/mp.2020.001.04
Resumen
Las enfermedades transmitidas por alimentos (ETAs) representan un problema de salud pública a escala mundial. Son transmitidas por el consumo de agua o alimentos contaminados con microorganismos vivos o sus toxinas. Una de las principales estrategias para combatir las infecciones y toxiinfecciones que caracterizan a las ETAs, es la eliminación o reducción del patógeno en el alimento mediante técnicas de preservación. Entre los métodos más comunes de preservación se encuentra la pasteurización, la congelación, refrigeración, adición de sales, azucares entre otros. Aunque estas técnicas han sido empleadas por años, pueden ocasionar alteraciones en el sabor, aroma y color de algunos tipos de alimentos. Por tal motivo, han surgido métodos de preservación alternativos, como la biopreservación, que consiste en la utilización de sustancias naturales con el fin de mantener la calidad de los alimentos controlando microorganismos deteriorantes y patógenos. Es por ello que esta revisión tiene como objetivo recopilar información sobre las ETAs y algunas de las bacterias patógenas asociadas a esta enfermedad, los focos de contaminación y la manera de eliminar o preservar los alimentos de dichos patógenos.
Palabras clave: Contaminación de alimentos, ETA, patógenos, preservación, refrigeración.
1. Introducción
Las enfermedades transmitidas por alimentos (ETAs) representan un problema de salud pública a escala mundial. Son transmitidas por el consumo de agua o alimentos contaminados con microorganismos vivos o sus toxinas [1]. Tales microorganismos pueden causar diarreas graves, vómitos, meningitis y hasta la muerte. Entre los principales microorganismos asociados con las ETAs se encuentra: Salmonella sp, Campylobacter sp, Escherichia coli, Listeria monocytogenes, Vibrio cholerae y Staphylococcus aureus [2].
La inocuidad de los alimentos junto con las ETAs constituye un problema de salud pública cada vez más importante. Se estima que las enfermedades gastrointestinales, transmitidas por el consumo de alimentos contaminados provocan la muerte de aproximadamente 2,2 millones de personas al año, [3]. De igual modo, ante un mundo globalizado y en creciente expansión, cada día las importaciones y exportaciones de alimento se incrementan, lo que conlleva a la propagación de patógenos a través de las fronteras, de manera que las enfermedades de transmisión alimentaria constituyen una amenaza para la seguridad pública a nivel mundial. A pesar de las deficiencias en la transmisión y reportes de datos y a las limitaciones de estas estimaciones iniciales, se evidencia una alta carga mundial de ETA [4-9].
Aunque los gobiernos y diversas organizaciones de todo el mundo realizan esfuerzos por aumentar la salubridad de los alimentos, la existencia de enfermedades de transmisión alimentaria sigue siendo un problema de salud significativo; tanto en los países desarrollados como en los países en desarrollo [3,6]. Por tal motivo, se deben promover e incrementar el número de investigaciones relacionadas con la preservación de los alimentos y el desarrollo de fármacos contra los organismos patógenos presentes en ellos [2,4,5].
El grupo más susceptible a las ETAs son los niños, debido a su inmadurez anatomofuncional alcanzan concentraciones más elevadas de sustancias tóxicas que afectan gravemente su desarrollo, por lo que se ven obligados a someterse a diversos tratamientos, muchas veces de altos costos, que le permitan recuperar su salud. Otro grupo susceptible a las ETAs, son los adultos mayores. De manera que al contraer una ETA, tienen mayor probabilidad de ser hospitalizados o incluso fallecer consecuencia de la infección [3,7,8].
Una de las principales estrategias para combatir las infecciones y toxiinfecciones que caracterizan a las ETAs, es la eliminación o reducción del patógeno en el alimento mediante técnicas de preservación. Entre los métodos más comunes de preservación se encuentra la pasteurización, la congelación, refrigeración, adición de sales, azucares entre otros. Aunque estas técnicas han sido empleadas por años, pueden ocasionar alteraciones en el sabor, aroma y color de algunos tipos de alimentos [9,10]. Sin embargo, la creciente demanda de productos "similares a los frescos" con calidad sanitaria, organoléptica y nutricional ha impulsado el desarrollo de tecnologías alternativas con el objetivo de suplir a las tradicionales o térmicas y garantizar de esta forma lo que el consumidor solicita [10]. Se han desarrollado investigaciones para evaluar el potencial antimicrobiano sobre agentes patógenos de alimentos a partir de metabolitos de plantas, hongos, bacterias y microalgas [11-13].
Estudios como los antes referidos han permitido el desarrollo de una técnica conocida como biopreservación, que consiste en la utilización de sustancias naturales con el fin de preservar la calidad de los alimentos controlando microorganismos deteriorantes y patógenos. La aplicación de sustancias antimicrobianas como una alternativa para la preservación de alimentos permitirá la disminución de los riesgos a la salud provocada por patógenos alimentarios así como la reducción de pérdidas económicas asociadas con alimentos contaminados. De igual modo permitiría remplazar compuestos sintéticos utilizados en la preservación de alimentos, que en muchos casos han evidenciado su efecto nocivo a la salud del consumidor [15,16]. De esta manera la identificación y utilización de antimicrobianos naturales y su caracterización respecto a la seguridad, especificidad y eficacia representan un objetivo clave para las investigaciones relacionadas con la industria alimentaria y farmacéutica [16]. Este artículo tiene como objetivo ofrecer el estado del arte sobre tópicos relacionados con bacterias patógenas de alimentos y su preservación.
2. Bacterias patógenas asociadas a alimentos
La contaminación de alimentos puede ocurrir en cualquiera de las etapas de la cadena productiva, desde la recolección de la materia prima, pasando por la recolección y transporte, hasta el momento de su consumo [17]. Los cuadros de ETA como enfermedad pueden ser de tres tipo: infecciones, intoxicaciones y toxiinfecciones alimentarias; como se observa en la Figura 1. La infección alimentaria, ocurre por la ingestión de un alimento contaminado por agentes patógenos viables, de manera que la enfermedad se genera por la invasión y multiplicación del patógeno [18]. En el caso de la intoxicación alimentaria ocurre por la ingestión de alimentos contaminados con toxinas preformadas de origen bacteriano o fúngico. En este caso no es necesaria la presencia del patógeno viable para generar el cuadro de la enfermedad [1,4,8]. Por último, las toxiinfecciones alimentarias son una combinación de las anteriores, donde el patógeno contaminante del alimento, produce las toxinas en el intestino tras la ingesta [4,8].
Una cantidad importante de ETAs son producidas por bacterias, que causan diversos daños y síntomas que van desde un leve malestar, hasta la muerte del paciente. El origen alimentario varía en relación a la bacteria siendo los alimentos contaminados más frecuentes enlatados, productos cárnicos, jugos, salsas, alimentos crudos, frutas y verduras [2,3] En la tabla 1 pueden observarse algunos ejemplos de bacterias patógenas asociadas a los alimentos y los síntomas.
Bacteria |
Síntoma |
Alimentos asociados |
Ref |
Aeromonas hydrophila, Aeromonas spp. |
Peritonitis, endocarditis, pneumonía, infección del tracto urinario |
Productos cárnicos en general |
[18] |
Arcobacter butzleri, y otras Arcobacter spp. |
Septicemia, bacteriemia |
Productos cárnicos en general |
[1] |
Campylobacter jejuni (O:19, O:4, O:1), y otras |
Artritis, pancreatitis, meningitis, Guillain- Barré, dolores abdominales, diarreas, dolor |
Leche cruda, hígado de res, almejas |
[19,22] |
Clostridium spp |
Vértigo, visión doble, dificultad para deglutir, hablar y respirar, parálisis respiratoria, |
Conservas caseras poco ácidas, |
[30] |
Escherichia coli (O157:H7, otros cepas productores de Shigatoxina |
Colitis hemorrágica, diarrea acuosa seguida por diarrea |
Alimentos diversos no tratados |
[31] |
Listeria monocytogenes |
Náusea, vómito, meningitis, meningoencefalitis, septicemia, abortos |
Leche, quesos, hortalizas |
[47-49] |
Salmonella Typhimurium (DT104, |
Fiebre tifoidea, dolor de cabeza, |
Leche, quesos, vegetales |
[60,61] |
Shigella sp. |
Dolores abdominales, diarrea, fiebre, |
Ensaladas, atún, pollo, |
[29,31] |
Staphylococcus aureus |
Náuseas, vómito, dolores |
Jamón, productos de carne de res |
[65,70] |
Vibrio cholerae |
Diarrea acuosa y profusa, vómitos, |
Pescados y mariscos crudos, |
[1,31] |
Yersinia enterocolitica |
Fiebre, dolores abdominales, diarrea, |
Productos cárnicos, ostras, pescado, leche |
[1,20,31] |
Tabla 1: Principales Bacterias involucradas en enfermedades alimentarias.
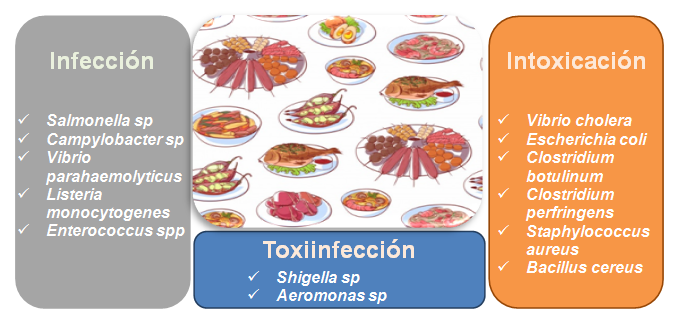
Figura 1. Tipos de ETA y principales bacterias involucradas.
Muchos de los microorganismos involucrados en las ETAs, son previamente conocidos y se ha documentado su trayectoria en este tipo de enfermedades. Mientras que los denominados patógenos emergentes, son cepas microbianas que no han sido previamente descritas en la contaminación de alimentos y que se han adaptado al estrés de estos entornos, ocupando nuevos nichos, por lo que las ETAs producidas por ellos, han sido erróneamente asociadas a otros microorganismos [18]. Algunos de estos patógenos emergentes son: Campylobacter Jejuni, Salmonella sp, Escherichia coli, Listeria monocytogenes entre otros. Estos microorganismos son capaces de causar envenenamiento por consumo de toxinas, como es el caso del botulismo, así como diarreas, colitis hemorrágica, listeriosis, salmonelosis, gastroenteritis entre otra gama de enfermedades que en algunos casos pueden desencadenar la muerte del paciente en cuestión de horas [19-21].
2.1. Campylobacter sp
El género Campylobacter corresponde a la familia campylobacteriaceae, son Gram-negativas con forma de espirilo, microaerófilos obligados, con temperatura óptima de crecimiento de 42 °C. Campylobacter jejuni tiene la capacidad de sobrevivir a la congelación y refrigeración, representando un riesgo a la salud publica en el área de alimentos [20]. Dado su dificultad para ser cultivado en el pasado, las epidemias producidas por esta bacterias fueron reportadas como agente desconocido o erróneamente atribuida a otros microorganismos especialmente Salmonella sp. La enfermedad alimentaria producida por el género Campylobacter lleva el nombre de campylobacteriosis [18,20]. En la Tabla 2 se puede observar algunos brotes de campylobacteriosis a nivel mundial.
Campylobacter spp puede aislarse de diferentes animales, siendo las aves de corral especialmente sensibles a la infección por dicha bacteria. De manera que su transmisión ocurre principalmente por la manipulación y consumo de productos cárnicos y leche contaminada [20,28]. Los huevos, a pesar de estar involucrado con aves, no se consideran una fuente importante de contaminación. La campylobacteriosis es frecuente en los meses de verano y tiene un periodo de incubación de 3-5 días. Entre sus síntomas destaca la diarrea, fiebre y dolores abdominales. Aunque esta enfermedad no posee una alta tasa de mortalidad puede resultar en complicaciones secundarias como artritis, pancreatitis, meningitis, endocarditis y el síndrome de Guillain- Barré [19]. Campylobacter jejuni O:19 y otros serotipos (O:4, O:1), son los agentes etiológicos más comunes de este síndrome. Además se ha descrito la resistencia de la bacteria al antibiótico ciprofloxacina y tetraciclina, evidenciándose la capacidad adaptativa de este microorganismo ante condiciones adversas [18,20].
Año |
Lugar |
Infectados |
Alimentos asociados |
Ref. |
2019 |
Perú |
7 |
No reportado |
[21] |
2001-2016 |
Australia |
2084 |
Leches y productos cárnicos |
[19] |
2005-2015 |
Dinamarca |
1823 |
Productos carnicos, agua, lechuga |
[23] |
1997-2008 |
Estados Unidos |
9135 |
Leches, queso, productos carnicos. |
[24] |
2019 |
Noruega |
2000 |
agua contaminada para el consumo. |
[25] |
Tabla 2: Diversos brotes de campylobacteriosis en el mundo.
2.2. Clostridium sp
Bacteria Gram-positiva perteneciente a la familia Clostridiaceae sus características son variadas de acuerdo a la especie. Entre sus características generales incluye anaeróbicos obligados y aerotolerantes, con la capacidad de formar esporas en ausencia de oxígeno, posee diversas morfologías que van desde cocobacilos hasta filamentos largos. Bajo condiciones de estrés es capaz de formar endoesporas resistente al agua en ebullición y al aire. Su distribución es ubicua en la naturaleza encontrándose principalmente en el suelo. Sin embargo, su principal reservorio es el tracto intestinal animal y humano [29-31]. En la Tabla 3 se pueden observar algunos brotes causados por Clostridium sp.
Año |
Lugar |
Infectados |
Alimentos asociados |
Ref. |
2012 |
Eslovenia |
104 |
no reportado |
[33] |
2009-2010 |
Costa Rica |
84 |
no reportado |
[34] |
Tabla 3: Diversos brotes de Clostridium en el mundo
Dos especies correspondientes al género Clostridium son de interés alimentario. En primer lugar C. botulinum cuya importancia radica en la capacidad de producir una potente neurotoxina, sumado a la capacidad de producir esporas resistentes a altas temperaturas que pueden permanecer en alimentos mal o mínimamente procesados. De la neurotoxina botulínica existen siete tipos, basadas en la especificidad del antígeno. El ser humano solo se ve afectada por los tipos A, B, E y F. Esta bacteria produce la enfermedad del botulismo, la cual aparece tras el consumo de la toxina liberada por la bacteria durante su crecimiento. Esta enfermedad genera parálisis de los músculos incluido el sistema respiratorio [29-31].
Aunque la incidencia de la enfermedad es baja, es de gran importancia pues posee una alta mortalidad si no se trata al paciente inmediatamente. El tiempo de aparición de esta enfermedad es de 18-36 h tras la ingesta del alimento contaminado con la toxina. Sin embargo, se han reportado casos en el que los síntomas aparecen incluso a las 4 h [31]. Entre sus síntomas destacan visión doble o nublada, dificultad para tragar y debilidad muscular. Si la enfermedad prosigue sin tratamiento, desencadena en parálisis de brazos, piernas tronco y vías respiratorias. Los alimentos focos de contaminación varían de acuerdo a la preservación del alimento y a la correcta cocción, los más comunes son alimentos vegetales enlatados como maíz, pimientos, judías verdes, sopas, espárragos champiñones, aceitunas, entre otros [29-31]. De igual forma, productos cárnicos como atún, pollo, jamones y pescados [29].
La segunda especie de interés alimentario del género Clostridium es C. perfringens, a diferencia del anterior no posee motilidad, es aerotolerante y no produce la toxina botulínica. Aunque, produce otro tipo de toxinas que pueden también afectar al ser humano. La temperatura de crecimiento es amplia para la célula vegetativa, pudiendo desarrollarse en ambientes que van desde los 6-50 °C, siendo su temperatura óptima de crecimiento de 43-47 °C. Crece a una concentración de cloruro de sodio de entre 5 a 8%, pudiendo variar este intervalo de acuerdo a la cepa. El pH de crecimiento que puede resistir es de 5 a 9, siendo el óptimo de 7 [29-31]. Clostridium es una especie encontrada con mayor frecuencia en muestras clínicas humanas, excluyendo las heces, convirtiéndola en la segunda bacteria más común causante de ETAs en Estados Unidos [5-7].
Las enfermedades causadas por C. perfringens pueden tomar dos formas. La primera en forma de gastroenteritis severa, que puede causar daños a la pared intestina raramente fatal. Sus síntomas son diarrea muy líquida y dolor abdominal moderados. La segunda es en forma de enteritis nectroticas, aunque es menos frecuente que la primera, suele ser fatal. Sus síntomas son: dolor abdominal con distención, diarrea, vómitos y necrosis de la pared intestinal [29,30]. Los alimentos que sirven de vehículo para contaminación con esta bacteria son alimentos mal cocinados, especialmente productos cárnicos y vegetales [34].
2.3. Escherichia coli
Bacteria Gram-negativa, en forma de bacilo, perteneciente a la familia Enterobacteriaceae. Es un organismo comensal, presente en intestino tanto de animales y humanos. No crece a temperaturas mayores a 50 °C, puede resistir pH ácido de entre 4-4,5 [29]. Se ha reportado resistencia a antibióticos en la cepa E. coli O157:H7, especialmente estreptomicina, sulfisoxazole y tetraciclinas [34]. En la Tabla 4 se pueden observar algunos brotes causados por E.coli.
La importancia de Escherichia coli verocitotoxigénicos (VTEC) como agentes causales de toxiinfecciones alimentarias está aumentando en el mundo en general y en Europa en particular. Entre los VTEC, el serotipo más frecuentemente implicado es el O157. El periodo de incubación es de entre 2- 10 días, tras lo cual aparecen los síntomas. Estos pueden ser: diarrea, dolor abdominal, vómitos, colitis hemorrágica, uremia hemolítica, trombocitopenia. El principal foco de contaminación de los alimentos con este organismo es el contacto con material fecal, resultado de una mala manipulación, transporte y preparación. De manera que, es un organismo indicador de la contaminación por materia fecal en alimentos y la posible presencia de patógenos entéricos [18,20,43]. Se ha reportado la contaminación por E.coli en productos cárnicos, leche, queso y otros derivados lácteos, embutidos [29,44].
Año |
Lugar |
infectados |
alimentos asociados |
Ref |
2013 |
Korea del Sur |
33 |
huevos y sopa |
[36] |
2011 |
Alemania |
3816 |
Coles |
[37] |
2011 |
Japón |
181 |
Carne avícola |
[38] |
2010-2011 |
Inglaterra |
251 |
Carne avícola y papas |
[39] |
2010 |
China |
112 |
Comercios de desayuno |
[40] |
2011 |
Francia |
42 |
Cárnicos y vegetal |
[41,42] |
Tabla 4: Diversos brotes de E. coli en el mundo.
2.4. Listeria monocytogenes
L. monocytogenes es un bacilo Gram-positivo, anaerobio facultativo, capaz de resistir a la refrigeración y temperaturas de hasta 45 °C. De igual modo, es capaz de tolerar un amplio rango de pH que va de 6 a 9. Así como altas concentraciones de NaCl (por encima de 10%) [29,45]. Este microorganismo posee la capacidad de crear biofilm, que le brinda resistencia contra diversos tratamientos antimicrobianos. Los principales reservorios de este microorganismo son el suelo, el forraje, el agua, silos de grano y el tracto gastrointestinal de aves, peces y mamíferos, incluyendo al hombre. En este último, la infección se adquiere mediante el consumo de alimentos contaminados. Entre los alimentos que pueden servir como fuente de contaminación son: carnes, pescado, vegetales crudos, lácteos no pasteurizados, helados, embutidos y otros productos refrigerados [29, 46-49]. En la Tabla 5 se pueden observar algunos brotes causados por L. monocytogenes en distintas partes del mundo.
Año |
Lugar |
infectados |
alimentos asociados |
Ref |
1990-2019 |
Estados Unidos |
768 |
Leche, ensaladas, quesos, vegetales, productos cárnicos, helados, camarones |
[45] |
1999-2006 |
Unión Europea |
8378 |
Productos carnicos, frutas, vegetales |
[45] |
2003-2018 |
Australia |
310 |
Melones, alimentos procesados, pollos |
[45] |
1996-2002 |
Japon |
92 |
Cerdo, pollo, bovino, leche queso |
[50] |
1964-2010 |
China |
147 |
Leche, carne, pescados, huevo, leches |
[51] |
2017-2018 |
Sur Africa |
820 |
No reportado |
[51] |
Tabla 5: Diversos brotes de L. monocytogenes en el mundo.
Este microorganismo es un patógeno facultativo, intracelular y oportunista. Produce la listeriosis, una ETA que afecta tanto a países industrializados como en vías de desarrollo. Esta enfermedad se puede agrupar en dos categorías basadas en sus manifestaciones clínicas: listeriosis invasiva y listeriosis no invasiva. En primer lugar la listeriosis invasiva, ocurre cuando la célula bacteriana atraviesa la pared intestinal y alcanza sistemas y órganos, como el sistema nervioso y el útero de la mujer, produciendo meningitis, septicemia, romboencefalitis entre otras dolencias. Por otro lado, está la listeriosis no invasiva, la bacteria no atraviesa la pared del intestino, limitándose a causar gastroenteritis, diarrea, fiebre, cefalea y mialgias. Siendo el tiempo de padecimiento de esta enfermedad corto comparado con la listeriosis invasiva [29, 47,52].
La listeriosis suele afectar principalmente a niños, ancianos, mujeres embarazadas y pacientes inmunosuprimidos. A pesar de su baja morbilidad comparada con otras ETAs, la listeriosis posee una elevada tasa de mortalidad que varía entre un 20 y un 30%. Lo que convierte a L. monocytogenes en un organismo prioritario en los planes de análisis de peligro y puntos de control críticos (HACCP) llevados a cabo en la industria de alimentos, al igual que en los planes de prevención de enfermedades de instituciones sanitarias [45,47]. Aunque solo 3 de los 13 serotipos de L. monocytogenes están asociados en mayor frecuencia a la listeriosis humana, para efectos de salud pública todos los serotipos de L. monocytogenes son calificados como patogénicos [47]. Algunos trabajos muestran el uso de sustancias con potencial de uso como biopreservante de alimentos contra L. monocytogenes, con ventajas de no producir cambios organolépticos en el alimento [53-55]. Aunque, esta bacteria todavía es sensible al efecto de un amplio rango de antibióticos, se ha observado la resistencia a la primera generación de quinolonas, fosfomycina y cefalosporinas. De manera que el antibiótico comúnmente utilizado para combatir la listeriosis son los ?-lactámicos con o sin ácido clavulónico [45].
2.5. Salmonella spp
Bacteria perteneciente al género Enterobacteriaceae. Son bacilos Gram-negativos, anaerobios facultativos, no formadores de esporas, poseen flagelos lo que les provee de movilidad. Se desarrolla en un rango de temperatura que va de 5 a 46 C°, siendo la temperatura óptima de crecimiento 37°C. Respecto al pH su crecimiento se ubica entre 3,8 a 9,5. No fermenta la lactosa ni producen desaminasas. La serotipificación de este organismo se logra mediante la detección de antígenos H y O. Este microorganismo no solo representa una amenaza a la salud, sino que también es causante de graves pérdidas económicas valoradas entre 2,3 y 11,3 billones de USD [34,51,57,58].
En humanos, pueden ocasionar dos modelos de infección, en primer lugar una infección generalizada que afecta el sistema retículo-endotelial con la aparición de fiebre. El segundo modelo es una infección localizada en el tubo digestivo consecuencia de la toxiinfección por el consumo de la batería [51,57-59]. Esta bacteria infecta al ser humano por la vía oral-rectal, resultado del consumo de agua y alimentos contaminados por materia fecal, por lo que resulta en un patógeno de interés alimentario. La distribución de la infección alimentaria causada por el género Salmonella es a escala mundial, siendo uno de los principales vehículos de infección el consumo de huevos contaminados por estos microorganismos, pues el tracto intestinal de las aves es el principal reservorio [60,61].
De igual modo la Salmonella está asociada con enfermedades diarreicas, las cuales continúan siendo una de las principales causas de morbilidad y mortalidad en lactantes, niños y ancianos [56]. En el caso de Latinoamérica se estima que la probabilidad de que un niño muera por una enfermedad diarreica antes de los 7 años puede ser de hasta un 50%, por lo que el control de esta bacteria es determinante para mantener los niveles de salud pública en un país. Requiriendo de un gran celo y cuidado en el diseño de las medidas proyectadas para controlar la diseminación de los microorganismos causantes de las intoxicaciones alimentarias en los diferentes aspectos del control microbiológico de la producción de alimentos [59]. La Tabla 6 muestra algunos brotes causados por Salmonella spp en diferentes partes del mundo.
Año |
Lugar |
Infectados |
alimentos asociados |
Ref |
1973-2011 |
Estados Unidos |
3684 |
Productos cárnicos de origen vacuno |
[60] |
2014-2017 |
España |
25 |
Posibles huevos contaminados |
[61] |
2014-2017 |
Portugal |
6 |
No reportado |
[61] |
2017 |
Francia |
10 |
No reportado |
[61] |
2017 |
Reino Unido |
296 |
Posibles alimentos avícolas (carnes y huevos) |
[61] |
Tabla 6: Diversos brotes de Salmonella en el mundo.
2.6. Staphylococcus aureus
Microorganismo Gram-positivo, con un tamaño que oscila entre 0,5 a 1,5 µm. Sus células tienen forma de cocos y se dividen formando agrupaciones similares a racimos de uva. Posee un cromosoma circular con un tamaño de entre 2,8 a 2,9 Mbp con un contenido de C+G de aproximadamente 33% [63,64]. Este organismo es capaz de afectar a la mayoría de los mamíferos y se ha reportado resistencia contra diversos antibióticos como es el caso de la penicilina [63]. S. aureus es una de las principales bacterias implicadas en ETA, esto se debe a la capacidad del patógeno de producir toxinas, de manera que las infecciones ocurren por la ingesta de alimentos contaminados por las toxinas del microorganismo, las cuales a pesar de ser de naturaleza proteica, presentan termorresistencia [64]. Existe una amplia variedad de alimentos capaces de albergar a S. aureus siendo más susceptibles aquellos que tienen contacto con la piel del animal, como es el caso de la leche, huevos, productos cárnicos [65,61]. Los síntomas aparecen después de 2-4 h tras el consumo [20,63]. En la Tabla 7 se pueden observar algunos brotes causados por S. aureus en diferentes partes del mundo.
Año |
Lugar |
Infectados |
Alimentos asociados |
Ref |
2014 |
Australia |
12 |
Sushi, pollo, agua, yogurt, café, frutos secos y jugos. |
[69] |
2011 |
Italia |
26 |
Posible ensalada |
[68] |
2017 |
Estados Unidos |
50 |
Comida de hostelería |
[70] |
2000 |
Japón |
13,420 |
Productos lácteos |
[66] |
2004 |
Brasil |
4000 |
No reportado |
[67] |
Tabla 7: Diversos brotes de S.aureus en el mundo.
3. Focos de contaminación en alimentos por patógenos
Los focos de contaminación de los alimentos varían de acuerdo a la localización del productor, la topología, el clima, la tierra, la cercanía e interacción con recintos para animales que favorecen el desarrollo de microorganismos saprófitos que pueden colonizar los alimentos, manipulación y traslado por parte del operador, el contacto con materia fecal proveniente de animales o humanos ya sea directo o indirecto mediante la contaminación de cuerpos de agua empleados en la irrigación. Dado el mínimo procesado de los alimentos frescos, y la carencia de pasos adicionales para reducir o eliminar microorganismos, lo hace especialmente sensible a la contaminación por estos patógenos [29,33,44,45].
3.1. Aguas de irrigación
El proceso de irrigación es la aplicación de agua a los suelos durante la agricultura. Es un requerimiento crítico para el adecuado crecimiento de los cultivos en las granjas, especialmente en las temporadas secas. De manera que satisfacer esta necesidad es un recurso clave para la producción, y no siempre se garantiza la calidad de las mismas debido a su contaminación por el proceso de industrialización, urbanismos, niveles de polución entre otros [44]. Existen diversas fuentes de agua para la irrigación, pudiéndose encontrar el agua residual tratada, aguas de superficie, aguas subterráneas o proveniente de la lluvia. En el caso de las aguas de superficie incluye lagos, estanques, ríos y presas. Aunque globalmente son los más usados para la agricultura, el hecho de estar expuestos al aire lo hace especialmente susceptible a la contaminación por microorganismos, comparado con otras fuentes de agua [44,45,52].
Además son susceptibles a la contaminación por la polución de origen doméstico e industrial. Pudiendo verse contaminada con metales pesados, carcinogénicos entre otros [44]. Esta fuente de agua se ve especialmente afectada por microorganismos de origen fecal por lo que su uso en la agricultura requiere de tratamientos que garanticen su inocuidad [44,52].
Otra fuente de agua para irrigación, son las aguas subterráneas, consideradas una fuente rentable en la agricultura. Al estar bajo tierra, generalmente posee menos contaminación que los cuerpos acuíferos superficiales. Sin embargo, se ha reportado que esta fuente de agua puede contaminarse por bacterias patógenas como E.coli, Staphylococcus sp y Clostridium resultado de una mala disposición de materiales en tierra así como tanques sépticos que percolan y contaminan las aguas profundas. A pesar de esto, la contaminación en general es mínima y suele ser adecuada para el uso agrícola. Su mayor limitación es que en largos periodos de sequía, existe una alta probabilidad de que se reduzca la disponibilidad de agua en el sistema acuífero, reduciendo la cantidad de agua que se puede emplear para la agricultura [17,52].
3.2. Suelo
El suelo destinado a la agricultura es foco de patógenos puesto que es su hábitat natural o son introducidos al emplear abonos a base de estiércol o vegetales contaminado [44,71-74]. Dado la exposición del suelo a cualquier partícula, y la variedad de nutrientes que posee, es especialmente sensible a la proliferación de microorganismos patógenos. Diversos factores como la acidez, la alcalinidad, la temperatura, humedad y cantidad de materia orgánica, puede provocar variaciones en la incidencia, existencia o persistencia del patógeno. A pesar de ello este es un foco difícil de controlar [74].
3.3. Abono a base de estiércol
La aplicación de estiércol animal antes del cultivo de plantas, es una técnica frecuente en la mayoría de los países con el fin de aumentar la fertilidad de los suelos y los rendimientos en las cosechas. Sin embargo, esta práctica puede incrementar la transferencia de patógenos como L.monocytogenes, Salmonella y E.coli al cultivo cuando el compost carece del tratamiento adecuado, observándose una alta correlación entre la presencia de este tipo de materia orgánica y la incidencia de patógenos entéricos cuando el producto crece en el suelo. Se han empleado diferentes estrategias para reducir o eliminar la presencia de estos patógenos en el compost, tales como: la aireación, calentamientos a temperatura de 64-67 °C durante 43 h, estabilización alcalina, secado por calor entre otros. Variando la eficiencia del método en relación al microorganismo presente [44,52,75].
3.4. Intrusión animal
La introducción intencional o sin intención de animales domésticos o salvajes puede ser una fuente contaminación en las granjas, pues ayudan a dispersar patógenos sobre la producción mediante las heces fecales que liberan durante su tránsito por el lugar de producción. Estos animales pueden causar ciertas zoonosis que también afectan al ser humano. Algunos de los patógenos asociados a la intrusión animal son: Campylobacter spp, E. coli O157:H7, Yersinia pseudotuberculosis y Cryptosporidium sp [44,72,75].
3.5. Contaminación durante la colecta del alimento
La contaminación de alimentos frescos por patógenos puede ocurrir durante la colecta del producto, resultado de que este entra en contacto con equipos, traslado en conteiner, herramientas y cuchillos, las manos del operador o guantes que facilitan la dispersión del patógeno sobre el producto [29,46]. Durante esta etapa de la producción, el operador juega un papel clave para la propagación de enfermedades, cuando no cumple las debidas normas higiénicas. Se estima que el 20% de las enfermedades alimentarias son el resultado de una manipulación deficiente por parte del operador. Incluso con el uso de guantes, existe la posibilidad de trasmitir el patógeno hacia los alimentos. Por lo que, se deben promover y garantizar el cumplimiento de las normas de bioseguridad durante la manipulación y colecta de los alimentos [73-75].
3.6. Contaminación después de la colecta
Tras la colecta de los alimentos, puede ocurrir contaminación de los mismos durante el transporte, almacenamiento y procesamiento. Durante el transporte de los alimentos, es especialmente necesario controlar la temperatura del recinto [73]. Esto no solo prolonga la vida útil del alimento evitando su deterioro, sino que ayuda a evitar la proliferación de microorganismos patógenos. Sin embargo, es importante garantizar la calidad de los sistemas de ventilación, de agua ya sea fría o hielo, para evitar que estos sean focos de transmisión [33,47,50].
Dado que los alimentos frescos, suelen estar mínimamente procesados, las etapas de lavados, cortados, secados y almacenamiento favorece la contaminación durante cualquiera de estas etapas. La contaminación del alimento, también puede ser cruzada por la combinación de diferentes alimentos de origen distinto, como el picado de verduras con cuchillos empleados en los cárnicos. Así mismo, los equipos de trabajo pueden ser fuente de contaminación. Los sitios de distribución de alimentos tal como: restaurantes, centros de comida rápida, locales comerciales o cualquier lugar que sirva de distribuidor en la red alimentaria puede verse contaminado por la manipulación deficiente de los operadores al no cumplir las normas higiénicas [52, 74,75].
4. Métodos de preservación de alimentos
La preservación de los alimentos es una de partes más importantes de la salud humana. Su principal objetivo es prolongar las propiedades del alimento desde su colecta o preparación hasta que llega al consumidor. Así como evitar la proliferación de microorganismos que por la acción de sus enzimas puedan deteriorar el alimento o sean patógenos para el ser humano. Mediante la aplicación de tratamientos tradicionales como: secado, adición de ácidos, congelación, fermentación, salado, ahumado, adición de componentes químicos entre otros [9,10]. Sin embargo, la aplicación de estos métodos trae consigo la alteración de las propiedades organolépticas del alimento: perdida de su sabor natural, desnaturalización de proteínas, perdida de la estructura del alimento, formación de nuevos componentes no deseado, perdida de color entre otros [9]. Sumado a esto, la creciente demanda por parte de los consumidores por alimentos frescos ha impulsado el interés de nuevos tratamientos que logren preservar los alimentos sin que se vea alterado las propiedades organolépticas de los mismos, y de esta manera sustituir de manera progresiva los tradicionales [9,56,57]. En la tabla 7 se observan algunos ejemplos de métodos de preservación tradicionales.
Tipo de método |
Método |
Alimento |
Tiempo de anaquel |
Tratamiento térmico |
Pasteurización. |
Jugos envasados, leche, bebidas fermentadas, alimentos ácidos |
3-7 semanas |
Esterilización. |
Leche, productos cárnicos, enlatados, maíz, zanahorias y otros vegetales, |
meses-años |
|
Cocción. |
Leche, huevos, frutas vegetales, pescado, pollo y otros alimentos cárnicos. |
días- semanas |
|
Disminución de la temperatura. |
Refrigeración. |
Leche, quesos, carnes, pescado, verduras, hortalizas, frutos, dulces |
5 días-semanas(varia en relación al alimento) |
Congelación. |
Frutas, derivados lácteos, verduras, granos, productos carnicos, mariscos, pescados. |
1 semana-12 meses. |
|
Reducción de la actividad del agua |
Secado |
Vegetales, frutas, verduras, carnes |
12 meses |
Adición de solutos |
Frutas, carnes, vegetales |
semanas-meses |
|
liofilización |
Carnes, frutas, verduras, salsas, champiñones |
meses-años |
|
Uso de microorganismos. |
Fermentación |
Quesos, yogurt, bebidas alcohólicas |
meses-años |
| Tabla 7. Ejemplos de métodos de preservación de alimentos tradicionales comúnmente usado en la industria. |
4.1. Métodos de tradicionales de preservación de alimentos
4.1.2. Tratamiento térmico
Es uno de los métodos más comúnmente utilizados en la preservación tradicional de los alimentos. Consiste en el calentamiento a determinadas temperaturas, que logren la eliminación o inactivación de los microorganismos y sus enzimas mediante la desnaturalización de proteínas o disolviendo lípidos que constituyen a la célula. Sin embargo, también pueden ocurrir reacciones no deseada como cambios de color y destrucción de nutrientes, lo que modifica las propiedades naturales del alimento [10,76].
Entre los métodos más comunes, se tiene la pasteurización y la esterilización. La esterilización es un proceso en el que se emplean temperaturas elevadas de entre 120 a 150°C a una presión específica, en la que el producto final está libre de células vegetativas y esporas. Este método agrega seguridad y estabilidad al alimento por largos periodos de tiempo [77,78]. Mientras que la pasteurización usada frecuentemente en jugos, leches, bebidas fermentadas, y otros alimentos similares, es un proceso térmico intermedio en el que se alcanzan temperaturas promedios de 75°C cuyo objetivo es reducir la población microbiana para prolongar la vida útil del alimento [79]. Debe ser acompañado por otros métodos de preservación para garantizar su eficiencia. Su tiempo de efectividad es de bajo a mediano plazo dependiendo del tipo de alimento sobre el cual se aplica [9,10].
4.1.3. Enfriamiento
Este método consiste en la disminución de la temperatura del alimento y el mantenerlo bajo esas condiciones durante su almacenamiento. Es muy utilizado en la industria alimentaria puesto que los cambios que genera en las propiedades organolépticas del alimento son muy bajas comparado con otros métodos [75]. Dado que la temperatura es una medida física relacionada con la energía del sistema, a bajas temperaturas la energía molecular es baja, en consecuencia disminuyen las reacciones involucradas en el sistema. En el caso del enfriamiento a temperaturas bajas, en la que el agua aún permanece en estado líquido, existen microorganismos que pueden desarrollarse a temperaturas bajas, proliferando incluso con la aplicación de este método [81]. De esta manera, el enfriamiento puede no reducir el crecimiento microbiano, más bien previene el desarrollo de los microorganismos que no resisten las bajas temperaturas, por lo que sirve de medio selectivo. En consecuencia, para garantizar la eficiencia del mismo, debe ser acompañado por otros métodos de preservación [10,81].
A parte del enfriamiento, se puede emplear la congelación. Método que a diferencia del anteriormente descrito, se disminuye la temperatura a niveles que favorecen la congelación del agua, evitando que esta se encuentre disponible. De esta forma, se reduce de manera drástica la movilidad molecular evitando que se lleven a cabo la mayoría de las reacciones químicas. Es un método muy efectivo aunque debe ser acompañado de otros métodos de preservación dada la capacidad de algunos microorganismos para entrar en fase de latencia, y resistir hasta la aparición de condiciones más favorables [9,80].
4.1.4. Reducción de la actividad del agua
Conocer el contenido de agua en los alimentos, no es suficiente para comprender las reacciones químicas que puedan ocurrir en el sistema, dado que las moléculas de agua pueden unirse a otras moléculas y por ello no estar disponible para las reacciones enzimáticas, microbiológicas o productos fisicoquímicos. Es por ello que se requiere del uso de un término más preciso denominado actividad del agua, el cual indica la cantidad de agua disponible para que una reacción química pueda ocurrir. La disminución de la disponibilidad del agua se traduce en una disminución de las reacciones químicas en los alimentos, incluyendo el metabolismo de microorganismo y por tanto su desarrollo en el alimento. La reducción de la disponibilidad del agua puede resumirse en dos grandes grupos de metodologías: la deshidratación y la deshidratación térmica osmótica [80-82].
La deshidratación osmótica, es especialmente utilizada en carnes, frutas y vegetales. En este proceso se reduce el agua disponible mediante la inmersión del alimento en una solución concentrada. Entre los solutos frecuentemente utilizados, destaca las sales como cloruro de sodio, nitrato de potasio, nitritos y otros nitratos para la preservación de carnes y quesos. El salado es un proceso de miles de años que genera un producto estable en el tiempo, sino que también dichas sales sirven como preservativos protegiendo el alimento de la mayoría de microorganismo. Otros solutos empleado para preservar las frutas consiste en la adición de azucares para provocar la deshidratación del alimento [9,10,82].
Este método tiene algunas desventajas, siendo la principal desventaja que modifica las propiedades organolépticas del producto tal como: color, aroma, textura, aumento de la salinidad, disminución de la acidez entre otras características que difieren al producto fresco. Otra limitación es el manejo de los almibares, su composición, concentración, reciclado, solutos empleados afectan el costo del almíbar lo cual limita su uso. De igual manera a lo descrito para la adición de sales puede alterar las propiedades organolépticas del alimento [10].
Otra manera de disminuir la actividad del agua, diferente a la adición de solutos, es el secado. Este método ha sido utilizado a través de los siglos, primero mediante la exposición al sol y ahora haciendo uso de sofisticados equipos automatizados. El secado reduce la actividad del agua preservando al alimento del crecimiento de microorganismos y el deterioro por reacciones químicas. Esto se logra principalmente calentando el alimento directamente o mediante cambios de presión y temperatura con el fin de evaporar el agua presente en la muestra. La técnica de secado no puede ser utilizado para todos los alimentos. A pesar de ser un método altamente efectivo, posee efectos secundarios no deseado en el alimento, como pardeamiento, perdida de color aroma, textura, perdida de vitaminas y proteínas entre otros aspectos que modifican las propiedades nativas del alimento [80-82].
4.1.5. Modificación del pH
El termino pH se emplea para referirse a la concentración de iones hidrógeno en un determinado compuesto. Este paramento ejerce un papel controlador en las principales reacciones químicas, bioquímicas y microbiológicas que ocurren en los alimentos. En consecuencia, su modificación puede evitar la proliferación y deterioro de los alimentos. El modo de acción de la variación del pH puede ser a nivel de desnaturalización de enzimas y otras proteínas, aumento de la permeabilidad en la membrana hacia los protones y la disminución del pH citoplasmático. Todo esto afecta el metabolismo del microorganismo y evita su crecimiento [10].
La disminución del pH favorece la eficiencia de otros métodos de esterilización, por lo que su uso combinado aumenta la eficiencia de la preservación. En el caso de la preservación por calentamiento, pH bajos requieren de una menor temperatura para lograr la esterilización. De igual modo, aumenta la eficacia de algunos preservativos químicos en la eliminación de microorganismos, respecto a su utilización sin el ácido. Otra ventaja de la acidificación, es que a los consumidores les agrada el sabor ácido en los alimentos [80,83]. Para modificar el pH se puede agregar acidulantes como el ácido acético, cítrico, ascórbico y láctico o mediante la acción de microorganismos que liberan ácidos al medio durante su metabolismo [10,84]. El desarrollo de estos microorganismos es controlado por la propia acción de estas sustancias ácidas, especialmente ácido láctico o acido ascético [10].
4.2. Métodos de preservación alternativos
Los métodos tradicionales de preservación de alimentos, frecuentemente modifican las características organolépticas del alimento, provocan la perdida de nutrientes e incluso la estructura de los mismos. En consecuencia, cada día aumenta la demanda de alimentos que sean de fácil consumo y tengan alta calidad nutricional, aroma y sabor lo más similar posible a los alimentos frescos o mínimamente procesados [76]. En respuesta a este movimiento, en los años recientes la industria alimentaria ha incrementado su interés en diseñar nuevos métodos que aunque preserven el producto, conserven la calidad, tengan bajo impacto ambiental y tengan sobre el producto un valor agregado. Las nuevas metodologías abarcan desde métodos físicos hasta químicos, siendo el uso de compuestos microbianos de origen natural una estrategia que ha cobrado fuerza en los últimos años [15].
5. Consideraciones finales y expectativas futuras
Las ETAs continúan siendo un grave problema a nivel mundial, afectando no solo a los países en vía de desarrollo sino también a los países desarrollados. Sumado al hecho de que muchos patógenos alimentarios, están adquiriendo resistencia a los antibióticos que sirven para el tratamiento de pacientes afectados, así como muchos procesos de preservación y manipulación inadecuados empleados en la industria de alimentos, hace con que la tecnología e inocuidad alimentaria sea fundamental para prevenir brotes de ETAs. Se debe promover la investigación de nuevos métodos de preservación de alimentos que eviten la entrada o eliminen al patógeno de la cadena alimentaria antes que llegue al consumidor. Estas estrategias deben satisfacer la creciente demanda de alimentos frescos, naturales e higiénicos. La aplicación de la ciencia y tecnología de alimentos, persigue proporcionar herramientas adaptadas a la necesidad real de mantener servicios adecuados en todos los niveles productivos de la cadena de alimentación. La búsqueda de elementos naturales que puedan ser empleados como preservante es muy beneficioso para la industria de alimentos ya que presenta ventajas como ser biodegradable, menos tóxico que otras sustancias coadyuvantes, no desequilibrar la biodiversidad de los agroecosistemas, no alterar las características organolépticas del producto, todo esto tendría gran impacto en la economía ya que, al contar con un buen control de los microorganismos, se prolongaría el tiempo de vida útil del alimento en anaquel, protegiéndolo de la putrefacción, perdida de color, sabor y valor nutritivo. Por esto, los alimentos producidos tendrían una mejor calidad y lo que se vería reflejado en las ventas del producto. Además, podría generar brechas de gran interés para la industria farmacéutica porque a partir de un producto con capacidad para inhibir microorganismos se pueden originar nuevos antibióticos para el control de patógenos.
6. Referencias
[1] Kopper G., Calderon G., Gutierrez G. Enfermedades transmitidas por alimentos y su impacto socioeconómico. Estudios de caso en Costa Rica, El Salvador, Guatemala, Honduras y Nicaragua. Roma: FAO 2009; 195 p.
[2] Organización Mundial de la Salud (OMS). 2015. Estimaciones de la OMS sobre la carga mundial de Enfermedades de Transmisión Alimentaria. Recuperado de: http://apps.who.int/iris/bitstream/10665/200047/1/WHO_FOS_15.02_spa.pd.
[3] Torrens H.R., Argilagos G.B., Cabrera M.S., Valdés J.B., Sáez S.M., Viera G.G. Las enfermedades transmitidas por alimentos, un problema sanitario que hereda e incrementa el nuevo milenio. REDVET. Revista Electrónica de Veterinaria 2015; 16(8):1-27.
[4] Joint FAO/WHO Codex Alimentarius Commission, & World Health Organization. Codex Alimentarius. Higiene de los alimentos: textos básicos; 2001.
[5] Organización Mundial de la Salud (OMS). 2015. Inocuidad de los alimentos. Recuperado de: http://www.who.int/mediacentre/factsheets/fs399/es/.
[6] World Health Organization. WHO estimates of the global burden of foodborne diseases: foodborne disease burden epidemiology reference group 2007-2015. World Health Organization; 2015.
[7] Soto Varela Z., Pérez Lavalle L., Estrada Alvarado D. Bacterias causantes de enfermedades transmitidas por alimentos: una mirada en Colombia. Revista Salud Uninorte 2016; 32(1):105-122. http://dx.doi.org/10.14482/sun.32.1.8598.
[8] Joint, FAO. Caracterización de peligros de patógenos en los alimentos y el agua: directrices; 2003.
[9] Barba F.J. de Souza Sant'Ana A., Orlien V., Koubaa M. Innovative technologies for food preservation: Inactivation of spoilage and pathogenic microorganisms. Academic Press; 2017.
[10] Rahman M.S. Handbook of food preservation. CRC press; 2007.
[11] Ramírez Mérida L.G., Moron de Salim, A., Reyes D., Rivero A., Sánchez L.A., Sánchez L.K. Antimicrobial effect of ethanol extract of leaf neem (Azadirachta indica A. Juss) on Listeria monocytogenes. Archivos Latinoamericanos de Nutrición 2016; 66(1):60-65.
[12] Shin T.Y., Bae S.M., Woo S.D. Screening and characterization of antimicrobial substances originated from entomopathogenic fungi. Journal of Asia-Pacific Entomology 2016; 19(4):1053-1059. https://doi.org/10.1016/j.aspen.2016.09.008.
[13] Padrão J., Pinheiro A., Vicente A., Dourado F., Silva J., Rodrigues L., Gonçalves S., Lanceros-Méndez S., Sencadas V. Bacterial cellulose-lactoferrin as an antimicrobial edible packaging. Food Hydrocolloids 2016; 58:126-140. https://doi.org/10.1016/j.foodhyd.2016.02.019.
[14] Pina-Pérez M.C., Rivas A., Martínez A., Rodrigo D. Antimicrobial potential of macro and microalgae against pathogenic and spoilage microorganisms in food. Food chemistry 2017; 235:34-44. https://doi.org/10.1016/j.foodchem.2017.05.033.
[15] Guedes A., Barbosa C.R., Amaro H.M., Pereira C.I., Xavier Malcata F. Microalgal and cyanobacterial cell extracts for use as natural antibacterial additives against food pathogens. International Journal of Food Science & Technology 2011; 46(4):862-870. https://doi.org/10.1111/j.1365-2621.2011.02567.x.
[16] Pisoschi A.M., Pop A., Georgescu C., Turcus V., Olah N.K., Mathe E. An overview of natural antimicrobials role in food. European Journal of Medicinal Chemistry 2018; 143:922-935. https://doi.org/10.1016/j.ejmech.2017.11.095.
[17] Iwu C.D., Okoh, A.I. Preharvest Transmission Routes of Fresh Produce Associated Bacterial Pathogens with Outbreak Potentials: A Review. International journal of environmental research and public health 2019; 16(22):4407. https://doi.org/10.3390/ijerph16224407.
[18] Mor-Mur M., Yuste J. Emerging bacterial pathogens in meat and poultry: an overview. Food and Bioprocess Technology 2010; 3(1):24.
[19] Moffatt C.R., Fearnley E., Bell R., Wright R., Gregory J., Sloan-Gardner T., Kirk M., Stafford R. Characteristics of Campylobacter Gastroenteritis Outbreaks in Australia, 2001 to 2016. Foodborne Pathogens and Disease 2020; 17(5):308-315. http://dx.doi.org/10.1089/fpd.2019.2731.
[20] Dhama K., Rajagunalan S., Chakraborty S., Verma A.K., Kumar A., Tiwari R., Kapoor S. Food-borne pathogens of animal origin-diagnosis, prevention, control and their zoonotic significance: a review. Pakistan Journal of Biological Sciences 2013; 16(20):1076-85. http://dx.doi.org/10.3923/pjbs.2013.1076.1085.
[21] Rodríguez-Morales A., Failoc-Rojas V., Díaz-Velen C. Gastrointestinal, respiratory and/or arboviral infections? What is the cause of the Guillain-Barré syndrome epidemics in Perú? Current status - 2019. Travel Medicine and Infectious Disease 2019; 30:114-116. http://dx.doi.org/10.1016/j.tmaid.2019.06.015.
[22] Skarp C.P.A., Hänninen M.L., Rautelin H.I.K. Campylobacteriosis: the role of poultry meat. Clinical Microbiology and Infection 2016; 22(2):103-109. http://dx.doi.org/10.1016/j.cmi.2015.11.019.
[23] Kuhn, K., Nielsen, E., Mølbak, K, Ethelberg, S. Epidemiology of campylobacteriosis in Denmark 2000-2015. Zoonoses and Public Health 2018; 65(1): 59-66. http://dx.doi.org/10.1111/zph.12367.
[24] Taylor E.V., Herman K.M., Ailes E.C., Fitzgerald C., Yoder J.S., Mahon B.E., Tauxe R.V. Common source outbreaks of Campylobacter infection in the USA, 1997-2008. Epidemiology & Infection 2013; 141(5):987-996. http://dx.doi.org/10.1017/S0950268812001744.
[25] Paruch L., Paruch A.M., Sørheim R. DNA-based faecal source tracking of contaminated drinking water causing a large Campylobacter outbreak in Norway 2019. International Journal of Hygiene and Environmental Health 2020; 224:113420. https://doi.org/10.1016/j.ijheh.2019.113420.
[26] Hanif Mughal, M. Campylobacteriosis: A Global Threat. Biomedical Journal of Scientific & Technical Research 2018; 11(5):8804-8088. https://doi.org/10.26717/BJSTR.2018.11.002165.
[27] Crim S.M., Griffin P.M., Tauxe R., Marder E.P., Gilliss D., Cronquist A.B., Cartter M., Tobin-D'Angelo M., Blythe D., Smith K., Lathrop S., Zansky S., Cieslak P.R., Dunn J., Holt K.G., Wolpert B., Henao O. Preliminary incidence and trends of infection with pathogens transmitted commonly through food-Foodborne Diseases Active Surveillance Network, 10 US sites, 2006-2014. MMWR. Morbidity and Mortality Weekly Report 2015; 64(18):495.
[28] Park C.J., Li J., Zhang X., Gao F., Benton C. Andam C. Genomic epidemiology and evolution of diverse lineages of clinical Campylobacter jejuni co-circulating in New Hampshire, USA, 2017. Journal of Clinical Microbiology 2020; 58(6):e02070-19. https://doi.org/10.1128/JCM.02070-19.
[29] Food and Drug Administration (FDA). Bad bug book. US Food and Drug Administration: Silver Spring, MD, USA; 2005
[30] Hailegebreal G. A review on Clostridium perfringens food poisoning. Global Research Journal of Public Health and Epidemiology 2017; 4(3):104-109.
[31] Bintsis T. Foodborne pathogens. AIMS microbiology 2017; 3(3):529-563. https://doi.org/10.3934/microbiol.2017.3.529.
[32] Rasetti-Escargueil C., Lemichez E., Popoff M. Public Health Risk Associated with Botulism as Foodborne Zoonoses. Toxins 2020; 17:1-24. https://doi.org/10.3390/toxins12010017.
[33] Fafangel, M., Ucakar, V., Vudrag, M., Berce, I., Kraigher, A. (2015). A Five Site Clostridium Perfringens Food-Borne Outbreak: A Retrospective. Slovenian Journal of Public Health, 54(1), 51-57. https://doi.org/10.1515/sjph-2015-0007.
[34] Wong-McClure, R. A., Guevara-Rodríguez, M., Abarca-Gómez, L., Solano-Chinchilla, A., Marchena-Picado, M., O'Shea, M., & Badilla-Vargas, X. Clostridium difficile outbreak in Costa Rica: control actions and associated factors. Revista Panamericana de Salud Pública, 2012.32: 413-418.
[35] World Health Organization. Foodborne disease outbreaks: guidelines for investigation and control. World Health Organization; 2008. 162 p.
[36] Park J., Oh S., Oh K., Shin J., Jang E., Jun B., Youn S., Cho S. Diarrheal outbreak caused by atypical enteropathogenic Escherichia coli O157:H45 in South Korea. Foodborne Pathogens and Disease 2014; 11:775-781. https://doi.org/10.1089/fpd.2014.1754.
[37] Frank C., Werber D., Cramer J., Askar M., Faber M., an der Heiden M., Bernard H., Fruth A., Prager R., Spode A., Wadl M., Zoufaly A., Jordan S., Kemper M., Follin P., Muller L., King L., Rosner B., Buchholz U., Stark K., Krause G. Epidemic profile of Shiga-toxin-producing Escherichia coli O104:H4 outbreak in Germany. The New England Journal of Medicine 2011; 365:1771-1780. https://doi.org/10.1056/NEJMoa1106483.
[38] Watahiki M., Isobe J., Kimata K., Shima T., Kanatani J., Shimizu M., Nagata A., Kawakami K., Yamada M., Izumiya H., Iyoda S., Morita-Ishihara T., Mitobe J., Terajima J., Ohnishi M., Sata T. Characterization of enterohemorrhagic Escherichia coli O111 and O157 strains isolated from outbreak patients in Japan. J Clin Microbiol 2014; 52:2757-2763. https://doi.org/10.1128/JCM.00420-14.
[39] Launders N., Locking M., Hanson M., Willshaw G., Charlett A., Salmon R., Cowden J., Adak G. A large Great Britainwide outbreak of STEC O157 phage type 8 linked to handling of raw leeks and potatoes. Epidemiology and Infection 2016; 144:171-181. https://doi.org/10.1017/S0950268815001016.
[40] Hao R., Qiu S., Wang Y., Yang G., Su W., Song L., Zhang J., Chen J., Jia L., Wang L., Song H. Quinolone-resistant Escherichia coli O127a:K63 serotype with an extended-spectrum-betalactamase phenotype from a food poisoning outbreak in China. Journal of Clinical Microbiology 2012;50:2450-2451. https://doi.org/10.1128/JCM.00276-12.
[41] King L., Nogareda F, Weill F., Mariani-Kurkdjian P., Loukiadis E., Gault G., Jourdan-DaSilva N., Bingen E., Mace M., Thevenot D., Ong N, Castor C., Noel H., Van Cauteren D., Charron M, Vaillant V., Aldabe B., Goulet V., Delmas G., Couturier E., Le Strat Y., Combe C., Delmas Y., Terrier F., Vendrely B., Rolland P., de Valk H. Outbreak of Shiga toxin-producing Escherichia coli O104:H4 associated with organic fenugreek sprouts, France, June 2011. Clinical Infectious Diseases 2012; 54:1588-1594. https://doi.org/10.1093/cid/cis255.
[42] King LA, Loukiadis E, Mariani-Kurkdjian P, Haeghebaert S, Weill FX, Baliere C, Ganet S, Gouali M, Vaillant V, Pihier N, Callon H, Novo R, Gaillot O, Thevenot-Sergentet D, Bingen E, Chaud P, de Valk H. Foodborne transmission of sorbitolfermenting Escherichia coli O157:[H7] via ground beef: an outbreak in northern France, 2011. Clinical Infectious Diseases 2014; 54:1588-1594. https://doi.org/10.1111/1469-0691.12736.
[43] Yang S., Lin C., Aljuffali I.A., Fang J.Y. Current pathogenic Escherichia coli foodborne outbreak cases and therapy development. Archives of Microbiology 2017; 199:811-825. https://doi.org/10.1007/s00203-017-1393-y.
[44] Iwu C.D., Okoh A.I. Preharvest Transmission Routes of Fresh Produce Associated Bacterial Pathogens with Outbreak Potentials: A Review. International journal of environmental research and public health, 2019.16(22): 4407. https://doi.org/10.3390/ijerph16224407.
[45] Kaptchouang Tchatchouang, C.D., Fri J., De Santi M., Brandi G., Schiavano G.F., Amagliani G., Ateba C.N. Listeriosis Outbreak in South Africa: A Comparative Analysis with Previously Reported Cases Worldwide. Microorganisms 2020; 8(1):135. https://doi.org/10.3390/microorganisms8010135.
[46] Artola B.S., Herrejón E.P. Infecciones por Listeria. Medicine-Programa de Formación Médica Continuada Acreditado 2010; 10(50):3368-3372.
[47] Muñoz, A. I., Vargas, M., Otero, L., Díaz, G., & Guzmán, V. Presencia de Listeria monocytogenes en alimentos listos para el consumo, procedentes de plazas de mercado y delicatessen de supermercados de cadena, Bogotá, DC, 2002-2008. Biomédica 2011; 31(3): 428-439.
[48] Ramírez L., Morón de Salim A., Alfieri A. & Gamboa O. Detección de Listeria monocytogenes en queso blanco criollo, mediante la reacción en cadena de la polimerasa (PCR). Archivos Latinoamericanos de Nutrición 2010; 60(3):254-260. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0004-06222010000300007&lng=es.
[49] Ramírez L., Morón de Salim A., Alfieri A. & Gamboa O. Frecuencia de Listeria monocytogenes en muestras de tomates (Lycopersicum esculentum) y cilantro (Coriandrum sativum) frescos en tres supermercados de Valencia. Venezuela. Archivos Latinoamericanos de Nutrición 2009; 59(3) 318-324. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0004-06222009000300013&lng=es&nrm=iso.
[50] Okutami A., Okoda Y., Yamamoto, S., Igimi S., Overview of Listeria monocytogenes contamination in Japan. International Journal of Food Microbiology 2004; 93:131-140. https://doi.org/10.1016/j.ijfoodmicro.2003.11.014.
[51] Feng Y., Wu S., Varma J.K., Klena J.D., Angulo F.J., Ran L. Systematic review of human listeriosis in China,1964-2010. Tropical Medicine & International Health 2013; 18:1248-1256. https://doi.org/10.1111/tmi.12173.
[52] Carstens C., Salazar J.K., Darkoh C. Multistate Outbreaks of Foodborne Illness in the United States Associated with Fresh Produce From 2010-2017. Frontiers in Microbiology 2019; 10:2667. https://doi.org/10.3389/fmicb.2019.02667.
[53] Ramírez L, Moron de Salim A, Catinella R, Castillo L. Efecto bacteriostatico y/o bactericida del extracto de gel de Aloe vera sobre cultivos de Listeria monocytogenes. Archivos Latinoamericanos de Nutrición 2012; 62(1):73-78. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0004-06222013000200009&lng=es.
[54] Moron de Salim A., Ramírez L. Efecto bacteriostático y o bactericida del xilitol sobre cultivos de L. monocytogenes. Archivos Latinoamericanos de Nutrición 2013; 63(2):173-179. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0004-06222013000200009&lng=es.
[55] Ramírez-Mérida L., Moron de Salim A., Reyes D., Rivero A., Sánchez L., Sánchez L. Antimicrobial effect of ethanol extract of leaf neem (Azadirachta indica A. Juss) on Listeria monocytogenes. Archivos Latinoamericanos de Nutrición 2016; 66(1):60-65. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0004-06222016000100007&lng=es.
[56] Jiméneza, R. J., Muñoza, C. A., Doblas, A., Delgadob, A. R., & Torre-Cisnerosa, J. Fiebre tifoidea y otras infecciones por salmonellas. Medicine 2010; 10(52): 3497-501. https://doi.org/10.1016/S0304-5412(10)70069-X.
[57] Barreto M., Castillo-Ruiz M., Retamal P. Salmonella enterica: una revisión de la trilogía agente, hospedero y ambiente, y su trascendencia en Chile. Revista chilena de infectología 2016; 33(5):547-557. http://dx.doi.org/10.4067/S0716-10182016000500010.
[58] McEntire J., Acheson D., Siemens A., Eilert S., Robach M. The public health value of reducing Salmonella levels in raw meat and poultry. Food Protection Trends 2014; 34(6):386-392.
[59] Acero D.P.R., Rueda R.Y.R., Medina J.C.V. Transmisión de Salmonella enterica a través de huevos de gallina y su importancia en salud pública. Revista de la Universidad Industrial de Santander. Salud 2011; 43(2):167-177. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0121-08072011000200008&lng=en&tlng=es.
[60] Laufer A.S., Grass J., Holt K., Whichard J.M., Griffin P.M., Gould L.H. Outbreaks of Salmonella infections attributed to beef-United States, 1973-2011. Epidemiology & Infection 2015; 143(9): 2003-2013. https://doi.org/10.1017/S0950268814003112.
[61] European Food Safety Authority, & European Centre for Disease Prevention and Control. Multi-country outbreak of Salmonella Enteritidis phage type 8, MLVA profile 2-9-7-3-2 and 2-9-6-3-2 infections. EFSA Supporting Publications 2017; 14(3):1188E.
[62] Pires S.M., Vieira A.R., Perez E., Wong D.L.F., Hald T. Attributing human foodborne illness to food sources and water in Latin America and the Caribbean using data from outbreak investigations. International Journal of Food Microbiology 2012; 152(3):129-138. https://doi.org/10.1016/j.ijfoodmicro.2011.04.018.
[63] Zendejas-Manzo G.S., Avalos-Flores H., Soto-Padilla M.Y. Microbiología general de Staphylococcus aureus: Generalidades, patogenicidad y métodos de identificación. Revista Biomédica 2014; 25(3):129-143.
[64] Fletcher S., Boonwaat L., Moore T., Chavada R., Conaty S. Investigating an outbreak of staphylococcal food poisoning among travellers across two Australian states. Western Pacific surveillance and response journal: WPSAR 2015; 6(2):17. https://doi.org/10.5365/WPSAR.2015.6.1.011.
[65] Yan X., Wang B., Tao X., Hu Q., Cui Z., Zhang J., Lin Y., You Y., Shi X., Grundmann H. Characterization of Staphylococcus aureus strains associated with food poisoning in Shenzhen. China. Appl. Environ. Microbiol 2012; 78:6637-6642. https://doi.org/10.1128/AEM.01165-12.
[66] Asao T., Kumeda Y., Kawai T., Shibata T., Oda H., Haruki K., Kozaki S. An extensive outbreak of staphylococcal food poisoning due to low-fat milk in Japan: estimation of enterotoxin A in the incriminated milk and powdered skim milk. Epidemiology and infection 2003; 130(1):33. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2869936/.
[67] Do Carmo L.S., Cummings C., Linardi V.R., Dias R.S., De Souza J.M., De Sena M.J., Dos Santos D.A., Shupp J.W., Pereira R.K., Jett M. A case study of a massive staphylococcal food poisoning incident. Foodborne Pathogens and Disease 2004; (4):241-246. https://doi.org/10.1089/fpd.2004.1.241.
[68] Gallina S., Bianchi D.M., Bellio A., Nogarol C., Macori G., Zaccaria T., Decastelli L. Staphylococcal poisoning foodborne outbreak: Epidemiological investigation and strain genotyping. Journal of food protection 2013; 76(12):2093-2098. https://doi.org/10.4315/0362-028X.JFP-13-190.
[69] Pillsbury A., Chiew M., Bates J., Sheppeard V. An outbreak of staphylococcal food poisoning in a commercially catered buffet. Communicable Diseases Intelligence 2013; 37(2):E144-E148.
[70] Marquez L., Koy T.H., Baker C.R., Graf J., Whaley E.M., Campbell J.R. Foodborne illness outbreak due to Staphylococcus aureus among hospital staff following Hurricane Harvey. Infection Control & Hospital Epidemiology 2019; 40(1):115-117. https://doi.org/10.1017/ice.2018.272.
[71] Patel J., Sharma M., Millner P., Singh M. Inactivation of E. coli O157:H7 attached to spinach harvester blade using bacteriophage. Foodborne Protection Diseases 2011; 8:541-546. https://doi.org/10.1089/fpd.2010.0734.
[72] Pachepsky Y., Shelton D.R., McLain J.E., Patel J., Mandrell R.E. Irrigation waters as a source of pathogenic microorganisms in produce: a review. In Advances in agronomy Academic Press 2011; p. 75-141. https://doi.org/10.1016/B978-0-12-386473-4.00007-5.
[73] Machado-Moreira B., Richards K., Brennan F., Abram F., Burgess C.M. Microbial Contamination of Fresh Produce: What, Where, and How?. Comprehensive Reviews in Food Science and Food Safety 2019; 18(6):1727-1750.
[74] Maffei D., Batalha E., Landgraf M., Schaffner D.W., Franco B. Microbiology of organic and conventionally grown fresh produce. Brazilian Journal of Microbiology 2016; 47:99-105. https://doi.org/10.1016/j.bjm.2016.10.006.
[75] Torrens H., Argilagos G., Cabrera M., Valdés J., Sáez S., Viera G. Las enfermedades transmitidas por alimentos, un problema sanitario que hereda e incrementa el nuevo milenio. REDVET. Revista Electrónica de Veterinaria 2015; 16(8):1-27.
[76] Amit S.K., Uddin M.M., Rahman R., Islam S.R., Khan M.S. A review on mechanisms and commercial aspects of food preservation and processing. Agriculture & Food Security 2017; 6(1):51. https://doi.org/10.1186/s40066-017-0130-8.
[77] Li M., Li Y., He J.K., Zhao W. Thermal and Non-thermal Sterilization Technologies in Food Processing [J]. Academic Periodical of Farm Products Processing 2013; 16.73.
[78] Ramesh M.N. Optimum sterilization of foods by thermal processing-a review, Food Science and Technology Today 1995; 9(4):217.
[79] Osorio O., Villareal Y., España D.F.M., Ceron A.F. Efecto de pasteurización sobre características sensoriales y contenido de vitamina C en jugos de frutas. Biotecnología en el Sector Agropecuario y Agroindustrial: BSAA 2013; 11(2):66-75. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S1692-35612013000200008&lng=en&nrm=iso.
[80] Piqueras M. Actualización en higiene alimentaria, manipulación, toxiinfecciones alimentarias y etiquetado de alimentos. Ciencias; 2016. 50 p.
[81] Barreiro J.A., Sandoval A.J. Operaciones de conservación de alimentos por bajas temperaturas. Equinoccio; 2006. 362 p.
[82] Duea W. The Complete Guide to Food Preservation: Step-by-step Instructions on how to Freeze, Dry, Can, and Preserve Food. Atlantic Publishing Company; 2011. 384 p.
[83] NPCS Board. Modern Technology on Food Preservation. Asia Pacific Business Press Inc.; 2012. 528 p.
[84] Sivasankar. Food Processing And Preservation. PHI Learning Pvt.Ltd.; 2002. 375 p.
Autor
Luis Daniel Martínez Angulo*
Centro de Biotecnología Aplicada, Departamento de Biología, Universidad de Carabobo, Campus Bárbula. Naguanagua. Código postal 2005. Carabobo, Venezuela.
* Autor de correspondencia: ldma.facyt@gmail.com
