AGROBIOLOGÍA - Una visión general y sus aplicaciones
CAPÍTULO 2
Microalgas para el manejo de aguas residuales,
actualidad y perspectivas
Luis Guillermo Ramírez Mérida
https://doi.org/10.4322/mp.2020.001.02
Resumen
El uso de microalgas para el desarrollo de diversos procesos industriales, ha venido aumentando en los últimos años debido a la diversidad y capacidad metabólica que poseen. Los residuos industriales ricos en nitrógeno y fósforo son removidos de manera significativa mediante bioprocesos microalgales, por lo que esta tecnología viene a impulsar mejoras en el proceso ya que además de proveer agua reciclada, genera bioproductos con valor añadido y disminuye las emisiones de gases de efecto invernadero. La tecnología aplicada con microalgas para el tratamiento de residuos industriales persigue generar procesos sostenibles, económicos y eficientes que garanticen el vertido de aguas bajo parámetros estándares que permitan preservar el medio ambiente y la calidad de vida de los ciudadanos. El empleo de lagunas algales de alta tasa presenta beneficios económicos, al tratar los efluentes contaminados y aprovechar la biomasa de microalgas generada. El crecimiento de microalgas en cultivos compuesto por aguas residuales puede verse limitado por la energía de iluminación o la fuente de carbono, esto debido a la gran carga de nutrientes y materia orgánica presente en estos efluentes. De igual forma, otros parámetros físicos, químicos y biológicos deben ser controlados para así garantizar que el proceso alcance su máximo rendimiento. Los altos volúmenes de residuos industriales, muchos de ellos con riesgos químicos bajos, pueden aprovecharse para producir a gran escala biomasa microalgal que genere empresas altamente lucrativas. Esta revisión pretende mostrar aspectos destacados resaltantes relacionados con el tratamiento de efluentes mediante el uso de microalgas.
Palabras clave: Aguas residuales, biomasa, efluentes agroindustriales, HRAP, pigmentos.
1. Introducción
El desarrollo sostenible y sustentable a nivel industrial es un proceso que ha venido ganando espacios en años recientes. Las plantas de tratamiento de aguas residuales industriales persiguen ir evolucionando e impulsando procesos más económicos, que generen mayor valor agregado y que sean amigables con el ambiente. De esta forma, establecer metodologías que equilibren los vectores medio ambiente, economía y sociedad será imprescindible en las plantas de tratamiento a mediano plazo. La preservación del medio ambiente es una necesidad y está rígidamente controlada por estándares regulatorios, por lo que la implementación de sistemas de control de la contaminación influye en gran medida sobre el impacto económico mundial. Por esto, la búsqueda de procesos industriales sostenibles representa un criterio decisivo en la elección de rutas tecnológicas de procesamiento industrial.
El tratamiento de las aguas residuales puede ser en tres niveles. Nivel primario, eliminando sólidos sedimentables que pueden causar problemas operativos en los pasos subsiguientes. Nivel secundario, donde un proceso físico y biológico interactúa consumiendo la materia orgánica disuelta y oxidando los nutrientes principales a nitrato y ortofosfato. Terciario, consiste en un tratamiento avanzado que elimina nitratos, fosfatos y compuestos orgánicos traza [1]. Normalmente, el nitrógeno es removido sin reciclaje convirtiéndolo en N2 que pasará a la atmósfera [2]. El fósforo se precipita principalmente mediante la adición de cationes como calcio, aluminio y hierro, lo que resulta en un proceso costoso [3]. Como alternativa para el tratamiento terciario y eliminación de nitrógeno y fósforo surge el uso de microalgas.
El tratamiento biológico de las aguas residuales con microalgas proporciona ventajas económicas y ambientales al proceso de operación. Durante el proceso metabólico de microalgas, se libera oxígeno que puede usarse para producir aireación mecánica o generar un ambiente aeróbico propicio para el crecimiento de bacterias que actúan en sinergia con las microalgas, desarrollando procesos más eficientes [4]. Por otro lado, la biomasa de microalgas producida puede usarse para generar varios productos de interés comercial [5].
Las características fisicoquímicas del efluente o del agua residual son de gran importancia para el desarrollo de microalgas cuyo propósito es reducir los compuestos orgánicos e inorgánicos del efluente, que servirán como nutrientes para la formación de biomasa, sin embargo, la eficiencia del tratamiento biológico dependerá del tipo de cepa utilizada [6]. La productividad y el rendimiento de microalgas en los sistemas agrícolas a gran escala y los métodos de recolección son clave para la implementación exitosa de esta tecnología, tanto para el tratamiento de aguas residuales como para la generación de productos de valor agregado [7]. En comparación con el tratamiento biológico convencional, la ventaja de usar microalgas en aguas residuales sin ningún tipo de tratamiento previo es que actúa como un floculante que mejora la velocidad de sedimentación.
Aunque las microalgas generalmente se adaptan eficientemente al ambiente de aguas residuales, generando procesos eficientes, el suministro de gas de combustión industrial en un solo sistema, favorece el crecimiento de biomasa que genera ventajas tales como: fijación de CO2, reducción de compuestos de nitrógeno y fosfatos, producción de mayor cantidad de bioproductos Figura 1.
El rápido crecimiento urbano en todo el mundo conlleva un aumento en el uso de los recursos hídricos, lo que conduce a una distribución poco uniforme y al agotamiento de los recursos de agua potable bien sea porque se desperdicia, está contaminada o se gestiona de manera no sostenible. Dado este hecho, el tratamiento de aguas residuales se aplica ampliamente para conservar el agua potable disponible, así como para mantener de forma apropiada las aguas servidas haciendo que los efluentes puedan reutilizarse o devolverse al medio ambiente en condiciones apropiadas. Entre las fuentes de aguas residuales (industriales, domésticas, agrícolas, entre otras), las de origen municipal tienen un mayor potencial para el crecimiento de microalgas [8].
Las microalgas se han utilizado para tratar las aguas residuales municipales por suspensión y por células inmovilizadas [9, 10]. Además, el tratamiento de aguas residuales se vuelve más eficiente cuando se usan piscinas de microalgas y bacterias [11]. De esta forma, el uso de microalgas para el tratamiento de aguas residuales representa una tecnología que viene a impulsar mejoras en el proceso ya que además de proveer agua reciclada, genere bioproductos con valor añadido y disminuye las emisiones de gases de efecto invernadero. Este capítulo busca mostrar de forma amplia aspectos relacionados con el tratamiento de efluentes mediante el uso de microalgas.
2. Función de las microalgas en el tratamiento biológico de aguas residuales
El agua residual es el resultado de acciones antropogénicas en el ambiente, pudiendo aparecer por procesos de escorrentías, domésticos e industriales. Poseen una composición muy variada y rica en nutrientes, lo que permite que pueda proliferar una gran diversidad de microorganismos que pueden ocasionar riesgos en la salud pública [12]. La acumulación de nutrientes en los cuerpos de agua favorece la multiplicación de organismos fototróficos, producto de la eutrofización del agua. Este fenómeno conlleva a la disminución del oxígeno disuelto en agua provocando la muerte de los organismos aeróbicos, lo que reduce la riqueza de especies y afecta gravemente la cadena trófica en el cuerpo de agua [13].
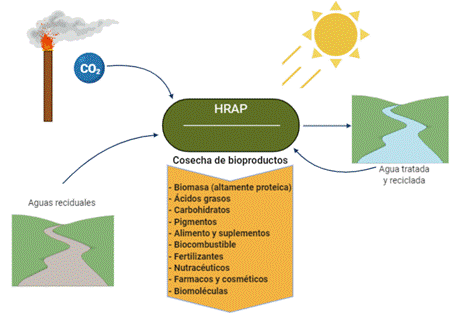
Figura 1. Esquema de tratamiento de aguas residuales con microalgas
El desarrollo de tecnologías sostenibles, económicas y eficientes para el tratamiento de aguas residuales es una acción clara por parte de investigadores y empresarios a fin de cumplir las normas nacionales e internacionales que garanticen el vertido de aguas bajo parámetros estándares que permitan preservar el medio ambiente y la calidad de vida de los ciudadanos [14].
La biorremediación, bioaumentación y mejoras en el proceso como la bioventilación y la bioestimulación, han mostrado ser muy eficientes en la depuración de aguas residuales eliminando contaminantes orgánicos e inorgánicos, como nitrógeno, fósforo, metales pesados, entre otros [15], así como compuestos xenobióticos, productos sintéticos tóxicos, no generados por procesos biosintéticos naturales, como halocarburos, nitroaromáticos, bifenilos policlorados, dioxinas, sulfonatos alquilbencílicos, hidrocarburos del petróleo y plaguicidas [16].
El empleo de microalgas para el tratamiento de aguas residuales, fue utilizado por primera vez en los años 1950 en California por William Oswald. El papel de las microalgas fue el de asimilar nutrientes y dar soporte a las bacterias mediante la producción fotosintética de oxígeno. Por su parte, las bacterias estarían involucradas en la degradación de materia orgánica, siendo el mismo proceso utilizado en los lodos activados [17]. En la actualidad, el uso de microalgas en el tratamiento de aguas residuales ha ganado espacio en procesos a escala piloto y de laboratorio, siendo las más utilizadas para este fin especies de Clorofíceas, dinoflagelados y cianobacterias.
Las microalgas tienen un sistema metabólico bastante amplio, fundamentalmente autotróficos, pudiendo ser heterotrófico y/o mixotrófico en ciertas especies. Por sus capacidades fotosintéticas, convierten la energía solar en biomasa, consumen una cantidad significativa de nutrientes para el crecimiento, ya que requieren altas cantidades de nitrógeno (N) y fósforo (P) para síntesis de proteínas (45-60% del peso seco de las microalgas), ácidos nucleicos y fosfolípidos. De esta manera, el empleo de microalgas en el tratamiento de aguas residuales ha sido utilizado ampliamente, en varios niveles, arrojando resultados promisorios.
Las microalgas son empleadas en el tratamiento de aguas residuales no solo por su capacidad para remover de manera significativa el nitrógeno y el fósforo sino también a su capacidad para eliminar organismos patógenos, esto debido al desarrollo de pH extremos y de sustancias con efecto antibacterial que pueden ser excretadas por ellas [18]. Por otro lado, es posible obtener bioproductos de interés industrial durante el bioproceso que generan valor agregado. Siendo la biomasa microalgal rica en lípidos, proteínas, polisacáridos, compuestos fenólicos, carotenoides, entre otros bioproductos pueden ser utilizados como fuente de ingredientes para productos funcionales en la industria de alimentos, que combinado con procesos de microencapsulación proporciona mayor estabilidad [19].
Organismos involucrados |
Producto evaluado |
Medio de cultivo |
Proceso |
%de remoción |
Ref |
C. sorokiniana, C. vulgaris y |
Biomasa |
Diclofenac |
FBR columna de burbuja. |
67 - 87 |
[21] |
Aphanothece microscópica Nägeli |
Clorofila-a |
Efluentes de procesamiento de productos |
Reactor en estado heterotrófico |
96,90 materia |
[22] |
Chlorella vulgaris |
Biomasa |
Agua residual proveniente de granja de ganado |
FBR |
79,84 DQO, 82,70 N y 98,17 P |
[23] |
Spirulina platensis |
Biomasa |
Efluentes de piscicultura |
Sistema abierto |
Más de 98,0 N, 95,0 P |
[24] |
Consorcio de microalgas, con predomino de Tetraselmis sp. |
Biomasa |
Efluentes de la industria de cuero |
FBR |
88,61 N y 92,58 P |
[25] |
Microalgas Clase Clorofícea |
Biomasa |
Efluentes urbanos |
Sistema integrado de microalgas, tanque de almacenamiento de efluentes y wetland de flujo vertical |
58,0 DBO, 63,0 P y 100 N amoniacal |
[26] |
C. biconvexa |
Biomasa |
Efluente agroindustrial de aceite de palma |
FBR air lift de placa plana |
64,13 N, 96 P |
[27] |
Chlorella vulgaris y Spirulina máxima |
Biomasa |
Laguna contaminada con residuos domésticos |
Sistemas abiertos |
Más de 86,0 nitratos, 82,0 de nitritos y 90,0 fosfatos |
[28] |
| Tabla 1. Procesos productivos microalgales en el tratamiento de residuos FBR: Fotobiorreactor |
Las aguas de desecho industrial presentan altas cargas de compuestos nocivo no solo para el ambiente sino también para los seres humanos. Debido a la capacidad de las microalgas de remover metales pesados, compuestos tóxicos orgánicos y xenobióticos, su uso no permite la contaminación secundaria. La industria farmacológica presenta muchas sustancias que al no ser metabolizadas por los pacientes son vertidas a los efluentes a través de la orina y las heces [20]. Estos productos pudieran ser una amenaza para el ecosistema en vista que estos compuestos están diseñados para estimular una respuesta fisiológica específica en el organismo diana. Sin embargo, cuando estas sustancias son vertidas a los cuerpos de agua entran en contacto con un sinfín de seres vivos, cuya reacción al fármaco es completamente desconocida, representando una seria amenaza para la el ambiente [21]. La Tabla 1 muestra algunos de estos procesos.
3. Laguna algal de alta tasa (High Rate Algal Ponds, HRAP)
Esta tecnología se inició en pequeñas comunidades rurales, debido a su simplicidad en el funcionamiento y su bajo costo, comparado con la tecnología de lodos activados. Estas lagunas permiten el desarrollo de la biomasa microalgal pues aprovecha todos los nutrientes presentes en el agua residual, así como la eliminación de otros contaminantes. La biomasa se puede comercializar para obtener diversos productos de interés industrial. Lo que ayuda a pagar los gastos de mantenimiento y construcción cuyo beneficio principal es un tratamiento efectivo de las aguas residuales, no solo de origen doméstico sino también a nivel industrial [29]. Estos sistemas aprovechan la capacidad de las microalgas para la fijación de dióxido de carbono, remoción de nitrógeno y fósforo, desarrollo de sustancias antibióticas para la eliminación de patógenos y la retención de metales pesados [30].
Las HRAP presentan alta productividad de biomasa microalgal y en comparación a las lagunas de estabilización poseen alta capacidad para el tratamiento de aguas residuales, esto debido a que su tiempo de retención celular es mayor que el tiempo de retención hidráulico. La mayoría de estos sistemas tienen una medida aproximada de 1 m de profundidad y 3 m de largo. Su forma es abierta y circular, lo que los hace dependientes de las condiciones externas, como el clima. La mezcla de los efluentes se realiza de manera continua y completa. En el caso del tiempo de retención hidráulico es de 2-8 días, mientras que tiempo de retención celular es de 4-13 días [31]. El funcionamiento del HRAP está basado principalmente en la oxidación de la materia orgánica mediante la oxigenación fotosintética proporcionada por las microalgas del sistema, las cuales aprovechan la energía solar y la materia orgánica. El oxígeno liberado durante la fotosíntesis es aprovechado por el resto de los microorganismos que también colaboran en la mineralización de nutrientes como nitrógeno y fósforo. Este sistema evidencia la capacidad de las microalgas para interactuar de manera simbiótica con la flora microbiana, reduciendo los agentes contaminantes del agua en forma conjunta [32].
La tecnología de HRAP, son utilizadas para tratar efluentes que ya pasaron por un tratamiento previo, con el fin de eliminar las sustancias contaminantes que persisten a los métodos convencionales. Esto es consecuencia de la extraordinaria capacidad de las microalgas para asimilar cantidades significativas de nutrientes orgánicos e inorgánicos disueltos, y no solo asimilan nutrientes, también contaminantes de distintas naturaleza [33]. Se han reportado la utilización de HRAP para el tratamiento de efluentes de criaderos de cerdos, donde se alcanzó una eliminación del DQO mayor al 90 % [34]. También se han empleado este sistema para el tratamiento de aguas residuales urbanas en Rabat, Marruecos, evidenciando una alta eficiencia en la eliminación de DQO, nitrógeno y fósforo, de 80, 85 y 63 % respectivamente. Además se pudo observar la eliminación de 1,23 unidades logarítmicas de coliformes fecales y la completa eliminación de huevos de helmintos [35].
El sistema HRPA no solo elimina contaminantes a través del mecanismo de asimilación de nutrientes, sino también por la volatilización del amonio generada por los grandes aumentos del pH en el agua, consecuencia de la intensa actividad fotosintética durante el día. Por otro lado, se logra la precipitación del fósforo mediante la unión con algunos cationes polivalentes como hierro, calcio y magnesio [36]. En diversos procesos de remoción de nutrientes inorgánicos con microalgas, el fósforo suele tener el menor rendimiento. Sin embargo, Xu et al. [37] adicionaron un biorreactor de membrana a base de Chlorella sp a un sistema HRPA, logrando una eliminación de hasta un 83,1 % del fósforo presente en el agua. Posteriormente se puede retirar la biomasa de microalgas y con ello el fósforo del agua residual. Este hallazgo permite la optimización de los sistemas de tratamiento de agua, aumentando el nivel de eliminación de fósforo, elemento fundamental para la eutrofización de los cuerpos de agua, y en consecuencia la perdida de diversidad.
Otro uso que tiene el sistema HRPA, es su aplicación como sistema secundario para el tratamiento de lixiviados de rellenos sanitarios. A pesar del éxito reportado, se sugiere un tratamiento previo para concentraciones altas de lixiviados, consecuencia de que el medio puede ser tóxico para la biomasa microalgal. Para el desarrollo de este sistema se emplearon Chlorella vulgaris, Scenedesmus quadricauda, Euglena gracilis, Ankistrodesmus convolutus y Chlorococcum oviforme. Se pudo observar que las microalgas lograron una buena reducción del DQO 91,0 %, nitrógeno amoniacal 99,9 % y fosfatos 86,0 % logrando además la acumulación de metales pesados como zinc, arsénico, cadmio, cobre, cromo y plomo. Sin embargo, la alta bioacumulación de metales en la microalga evita que su biomasa pueda ser empleada como alimento o en biofertilizantes, a pesar de ello es posible emplearla en la fabricación de biocombustibles, o simplemente limitar su uso a la recuperación de estos metales por desorción [38]. El mecanismo mediante el cual la microalgas eliminan metales pesados, consiste en la producción de péptidos, capaces de unirse a los metales, formando compuestos organometálicos que se acumulan en la vacuola con el fin controlar la concentración de iones de metales pesados en el citoplasma ayudando a prevenir o neutralizar los efectos tóxicos potenciales que poseen [39].
La tecnología de HRPA, se ha desarrollado principalmente en países con variación estacional. Al aplicar estos sistemas es fundamental que se tenga en cuenta las variables ambientales como: temperatura, luz solar disponible, precipitaciones, entre otras. Esto se debe a que son sistemas abiertos cuya dinámica ecológica se ve afectada por el entorno. Algunas modificaciones simples en la operación del estanque como los sistemas operados en serie, generan mayores rendimientos de biomasa microalgal y una mejor calidad del agua residual sin mayores costos de capital operativos [40]. Del mismo modo se ha evidenciado que las microalgas comúnmente empleadas para el desarrollo de estos sistemas corresponden a Scenedesmus sp., Microactinium sp., Ankistrodesmus sp., Euglena sp., Chlamydomonas sp., Desmodesmus sp., Chlorella sp., Dictyosphaerium sp., y Pediastrum sp. [41].
En las aguas residuales domésticas tradicionales, las relaciones de carbono a nitrógeno a fósforo (C: N: P) son 20: 8: 1, mientras que las relaciones C: N: P para microalgas son 50: 8: 1. El carbono adicional necesario para la fotosíntesis de microalgas se suministra a partir de dióxido de carbono libre, que es el principal factor limitante en los HRAP. Aunque las bacterias en los estanques generan una alta concentración de CO2, una alta tasa fotosintética puede crear un déficit de CO2. Se estima que el 30% del carbono total requerido por las microalgas se puede suministrar mediante la incorporación de CO2 en estos estanques [42].
4. Crecimiento microalga en limitaciones de iluminación
El crecimiento de microalgas en cultivos compuesto por aguas residuales puede verse limitado por la energía de iluminación o la fuente de carbono, esto debido a la gran carga de nutrientes y materia orgánica presente en estos efluentes [43]. El comportamiento del cultivo microalgal con iluminación limitada es diferente cuando la limitación es de nutrientes, en este último, la mayor densidad celular puede lograrse en estado estacionario. La densidad celular es, por lo tanto, constante y no es una función del caudal medio o del tiempo de retención hidráulica (HRT) promedio en el cultivo. En un cultivo con nutrientes limitados, la tasa de crecimiento disminuye y no habrá crecimiento neto de la población a medida que el nutriente limitante se agote [44]. El comportamiento microalgal en condiciones de cultivo discontinuo en aguas residuales presentará un crecimiento exponencial continuo, a medida que aumenta la densidad celular puede producirse solapamiento celular afectando la incidencia de iluminación por lo que la luz se convierte en el factor que limita el crecimiento.
Partiendo de esto, la circulación y rotación de las células en el medio de cultivo representa un factor de importancia para garantizar que un alto porcentaje de las células puedan ser alcanzadas por la intensidad de iluminación. Así, un buen sistema de mezcla y circulación de líquido en el sistema hace que las células no estén en iluminación u oscuridad constante, y por el contrario, alternan esta incidencia de luz para evitar procesos de fotosaturación o fotoinhibición y consecuentemente disminución de procesos metabólicos microalgales. La influencia de los ciclos de luz/oscuridad ha sido reportada como un factor determinante en la actividad fotosintética y en las tasas de crecimiento de las microalgas en sistemas de cultivo [45]. Siendo la luz un sustrato limitante en esos sistemas, los ciclos de luz/oscuridad proporcionan ciertas ventajas metabólicas a las células de microalgas. La producción de biomasa microalgas es proporcional a la intensidad de la luz proporcionada, y por lo tanto constante si la intensidad de la luz es constante.
En cultivos continuos con luz limitada, la densidad celular en estado estacionario será proporcional a la cantidad de fotones capturados durante el HRT promedio. La densidad celular por área, por lo tanto, depende principalmente del HRT y la intensidad de iluminación. A pesar del carácter fotoautotrófico de las microalgas, algunas especies tienen la capacidad de crecer sin luz en fuentes de carbono orgánico en lugar de dióxido de carbono, como ácidos orgánicos, azúcares, acetato o glicerol [46]. Algunos estudios muestran que el carbono orgánico total (TOC) y la DQO pueden reducirse entre un 20 a 50%. De igual forma, durante los ciclos de luz/oscuridad, la concentración celular es menor que la del esquema de iluminación continua, sin embargo, la tasa de eliminación específica de carbono orgánico en ciclos de luz/oscuridad muchas veces es mayor que durante la iluminación continua. Esto muestra que ciertas especies de microalgas presentan metabolismos heterotróficos en los períodos oscuros [47].
5. Producción de pigmento microalgal a partir de residuo agroindustrial
Las principales ventajas del tratamiento de aguas residuales por microalgas, es que no se genera contaminación adicional ya que la biomasa es cosechada y el reciclado eficiente de los nutrientes es posible. Los residuos agroindustriales tienen riesgos químicos bajos, están potencialmente disponibles a gran escala y pueden generar una biomasa, rica en pigmentos naturales y otras biomoléculas [48].
Las microalgas son una fuente de diversas moléculas bioactivas. Estos organismos poseen rutas metabólicas capaces de generar metabolitos primarios y secundarios que pueden ser utilizados para el uso en áreas de la industria química, de alimentos, farmacéutica, agraria y ambiental [49]. La producción de pigmentos mediante tecnologías eficientes y productivas, viene hacer un punto clave para una comercialización económicamente competitiva.
Entre los tres grupos de pigmentos encontrados en microalgas tenemos: carotenoides, ficobilinas y clorofila. Los carotenoides de microalgas, se han utilizado en propósitos comerciales debido a sus propiedades colorantes y alto poder antioxidante asociado con la prevención del cáncer, la arteriosclerosis, el envejecimiento y las enfermedades degenerativas [50].
El uso de ?-caroteno y luteína ha sido de gran importancia en la agroindustria, ya que se ha utilizado con grandes ventajas para la alimentación de las aves de corral debido a su importancia para la coloración amarillo-naranja de la yema de huevo y, para la alimentación en acuicultura [51]. Entre las ventajas de producir carotenoides de origen microalgal, está el hecho de ser un producto natural, a diferencia del ?-caroteno sintético, además la producción por microalgas permite la formación de isómeros trans y cis de carotenoides los cuales proveen amplia ventaja para procesos como antioxidantes [52], por otra parte, los carotenoides naturales pueden ser consumidos en grandes cantidades ya que el organismo regulará su uso [53].
Dunaliella salina fue la primera microalga que se comercializó como una fuente de producto químico de alto valor (aproximadamente USD 300-1500 kg-1) mostrando ciertas ventajas como, la capacidad de crecer en medios altamente salinos lo que evita riesgos de contaminación por otros microorganismos y altos contenidos de ?-caroteno [54].
Los carotenoides son productos intracelulares, por lo que su productividad depende de la cantidad de biomasa conseguida, y de factores relacionados con el medio de cultivo, tipo de cepa, y uso de un fotobiorreactor adecuado [55, 56]. La biomasa es el principal bioproducto para la biorefineria de pigmentos de microalgas, en este sentido, muchas iniciativas se han investigado para producir pigmentos futuros a partir de microalgas, sobre todo en una etapa experimental. La Tabla 2 muestra algunos pigmentos generados en el cultivo de microalgas.
Los procesos de producción en base a cultivos heterotróficos tienen un potencial bajo costo de producción, en comparación con la producción convencional de pigmentos por microalgas mediante cultivo fototrófico [54], desde que la materia prima utilizada para alimentar el cultivo es insignificante. Al comparar la producción de ficobiliproteínas y clorofila-a de Aphanothece microscopica Nägeli cultivada en sistemas autotróficos y heterotróficos utilizando efluentes de la industria láctea. Se observaron las mayores concentraciones de pigmento en la fase logarítmica: mayores concentraciones de clorofila-a en cultivos autotróficos y predominio de aloficocianina y ficoeritrina en cultivos heterotróficos. Los resultados mostraron el efecto de las variables en estudio para la producción de pigmentos, en la fase de crecimiento logarítmico, lo que indica la posibilidad de producir en sistemas heterotróficos de Aphanothece microscopica Nägeli, aproximadamente 3.185 ton/año de biomasa, para 3.127 kg/año clorofila, 232.825 kg/año ficocianina, 47.775 kg/año aloficocianina y 7.008 kg/año ficoeritrina, cuando se utiliza efluente de industria láctea como medio de cultivo [63].
Por lo que la potencialidad de producir pigmentos a partir de cultivos de microalgas utilizando residuos agroindustriales, puede considerarse como una plataforma emergente para la obtención de estos productos. Se sabe que especies de Spirulina pueden acumular hasta 0,8 a 1,0% p/p de ?-caroteno. Especies de Dunaliella salina y D. bardawil, está entre los principales organismos portadores de carotenoides, proporcionando en condiciones ideales, rendimientos de 400 mg ?-caroteno/m2 [64].
Pigmento |
Estructura química |
Microalgal representatives |
Application |
Ref. |
Bixina |
|
Dunaliella salina |
Colorante, aditivo de alimentos |
[57] |
?-Caroteno |
|
Botryococcus braunii, Dunaliella salina, Dunaliella bardawil |
Antioxidante, aditivo alimenticio |
[57] |
Astaxantina |
|
Haematococcus pluvialis |
Antioxidante, aditivo alimenticio para salmón. |
[58] |
Violaxantina |
|
Dunaliella |
Aditivo alimenticio, antitumoral |
[59] |
Luteina |
|
Chlorella sorokiniana, Dunaliella tertiolecta |
Aditivo alimentício, antitumoral, antioxidante, conseguir câmbios em la pigmentación de tejido animal. |
[60,61] |
Cantaxantina |
|
Nannochloropsis sp |
Aditivo alimenticio como colorante para salmón, y pollos |
[62] |
Tabla 2. Estructura química de pigmentos de microalgas y aplicaciones |
De igual forma, las investigaciones en cepas poco estudiadas para este fin, han evidenciado resultados prometedores, así Rodrigues et al. [65] cultivaron cepas de Phormidium autumnale en cultivo heterotrófico utilizando agua residual de matadero como medio de cultivo. Un total de (70,22 ?g g-1) de trans-?-caroteno, (26,25 ?g g-1) trans-zeaxantina, (21,92 ?g g-1) trans-luteina, (19,87 ?g g-1) trans-echinenona y (15,70 ?g g-1) cis-echinenona fueron separados de la biomasa microalgal, mostrando la posibilidad de obtener 107902,5 kg/año de carotenoide a escala industrial.
La aplicación del concepto de biorrefinería microalgal utilizando residuos agroindustriales, podría significar importantes oportunidades para el uso sostenible de los recursos. Siempre habrá conversión de contaminantes disueltos en las aguas residuales, contribuyendo a mejorar el medio ambiente durante el proceso productivo una vez que se dé la estabilización de los compuestos para la descarga en cuerpos de agua.
6. Consideraciones finales
El tratamiento de aguas residuales constituye un proceso fundamental para mantener un equilibrio ecológico, sanitario adecuado a las normativas establecidas. La sostenibilidad, eficiencia y economía en el tratamiento de aguas residuales es hoy en día una opción que se persigue alcanzar. El tratamiento biológico de las aguas residuales con microalgas proporciona ventajas económicas y ambientales al proceso de operación. En los últimos años, el interés en el uso de microalgas en el tratamiento de aguas residuales ha aumentado debido a la capacidad de evitar el uso de aireación en el proceso por la simbiosis microalgas y bacterias, así como por la generación de bioproductos que proporcionan valor agregado durante el bioproceso. La implementación de sistemas algales de alta tasa en el tratamiento de aguas residuales puede proveer tratamientos terciarios eficientes y de bajo costo. A su vez, es posible utilizar la biomasa de microalgas para la biofixación de CO2 y con ello ayudar a mantener la huella de carbono. Todo esto genera un proceso autosustentable que proporciona ventajas para el ambiente y la industria beneficiando la calidad de vida en el planeta.
7. Referencias
[1] Droste R.L. Theory and Practice of Water and Wastewater Treatment. New York, NY: JohnWiley and Sons; 1997.
[2] Muylaert K., Beuckels A., Depraetere O., Foubert I., Markou G., Vandamme D. Wastewater as a source of nutrients for microalgae biomass production. In: Moheimani N., McHenry M., de Boer K., Bahri P. (eds). Biomass Biofuels from Microalgae. Springer; 2015, p.75-94. Cham, Switzerland. http://dx.doi.org/10.1007/978-3-319-16640-7.
[3] George T., Franklin L., Stensel H.D. Wastewater Engineering: Treatment and Reuse. New York, NY: Metcalf and Eddy, Inc; 2003.
[4] Praveen P., Loh K.C. Photosynthetic aeration in biological wastewater treatment using immobilized microalgae-bacteria symbiosis. Applied microbiology and biotechnology 2015; 99(23):10345-10354. http://dx.doi.org/10.1007/s00253-015-6896-3.
[5] Koller M., Muhr A., Braunegg G. Microalgae as versatile cellular factories for valued products. Algal Research 2014; 6:52-63. https://doi.org/10.1016/j.algal.2014.09.002.
[6] Wang Y., Ho S., Cheng C., Guo W., Nagarajan D., Ren N., Lee D., Chang J. Perspectives on the feasibility of using microalgae for industrial wastewater treatment. Bioresource Technology 2016; 222:485-497. https://doi.org/10.1016/j.biortech.2016.09.106.
[7] Jacob-Lopes E., Ramírez-Mérida L.G., Queiroz M.I., Zepka L.Q. Microalgal Biorefineries. In: Jacob-Lopes E., Zepka L. (eds.) Biomass. InTech; 2015, p.81-106. Rijeka, Croatia. https://doi.org/10.5772/59969.
[8] Bhatnagar A., Bhatnagar M., Chinnasamy S., Das K.C. Chlorella minutissima-a promising fuel alga for cultivation in municipal wastewaters. Applied Biochemistry and Biotechnology 2010; 161:523-536. https://doi.org/10.1007/s12010-009-8771-0.
[9] Solé A., Matamoros V. Removal of endocrine disrupting compounds from wastewater by microalgae co-immobilized in alginate beads. Chemosphere 2016; 164:516-523. https://doi.org/10.1016/j.chemosphere.2016.08.047.
[10] Shi J., Podola B., Melkonian M. Application of a prototype-scale Twin-Layer photobioreactor for effective N and P removal from different process stages of municipal wastewater by immobilized microalgae. Bioresource Technology 2014; 154:260-266. https://doi.org/10.1016/j.biortech.2013.11.100.
[11] Su Y., Mennerich A., Urban B. Municipal wastewater treatment and biomass accumulation with a wastewater-born and settle able algal-bacterial culture. Water Research 2011; 45:3351-3358. https://doi.org/10.1016/j.watres.2011.03.046.
[12] Ajonina C., Buzie C., Rubiandini R.H., Otterpohl R. Microbial Pathogens in Wastewater Treatment Plants (WWTP) in Hamburg. Journal of Toxicology and Environmental Health A 2015; 78(6):381-7. https://doi.org/10.1080/15287394.2014.989626.
[13] Spietz R.L., Williams C.M., Rocap G., Horner-Devine M.C. A Dissolved Oxygen Threshold for Shifts in Bacterial Community Structure in a Seasonally Hypoxic Estuary. PLoS One 2015; 10(8):e0135731. https://doi.org/10.1371/journal.pone.0135731.
[14] Villena J.A. Calidad del agua y desarrollo sostenible. Revista Peruana de Medicina Experimental y Salud Publica 2018; 35(2) http://dx.doi.org/10.17843/rpmesp.2018.352.3719.
[15] Pereira A., Freitas D. Uso de micro-organismos para a biorremediação de ambientes impactados. REGET 2012; 6(6).
[16] Weber B.D., Santos A.A. Utilização da biorremediação como ferramenta para o controle da degradação ambiental causada pelo petróleo e seus derivados. Engenharia Ambiental - Espírito Santo do Pinhal 2013; 10(1):114-133.
[17] Oswald W.J. The high-rate pond in waste disposal. Developments in industrial microbiology 1963; 4:112-119.
[18] Ramírez-Mérida L.G., Zepka L.Q., Menezes C.R., Jacob-Lopes E. Microalgae as Nanofactory for Production of Antimicrobial Molecules. Journal Nanomedicine & Nanotechnology 2015; S6-004. http://dx.doi.org/10.4172/2157-7439.S6-004.
[19] Ramírez-Mérida L.G., Menezes C., Zepka L.Q., Jacob-Lopes E. Microalgas: potencial para la producción de compuestos bioactivos nanoencapsulados. Ciência e Natura 2015; 37:7-17. https://www.redalyc.org/pdf/4675/467547645002.pdf.
[20] Bilotta L. Implantação de um laboratório de análise da qualidade da água e efluentes de uma indústria farmacêutica. Revista Gestão Industrial 2014; 10(2):393-405. http://dx.doi.org/10.3895/S1808-04482014000200009.
[21] Escapa C., Coimbra R., Paniagua S., García A., Otero M. Comparative assessment of diclofenac removal from water by different microalgae strains. Algal Research 2016; 18:127-134. http://dx.doi.org/10.1016/j.algal.2016.06.008.
[22] Streit N., Ramírez Mérida L., Zepka L.Q., Jacob-Lopes E., Queiroz M.I. Producción de pigmentos naturales (clorofila-a) en biorrefinerias agroindustriales. Ciencia y Tecnología 2015; 8(2):27-34. http://www.uteq.edu.ec/revistacyt/publico/archivos/C2_V8%20N2%203Streit%20et%20al.pdf.
[23] Lv J., Liu Y., Feng J., Liu Q., Nan F., Xie S. Nutrients removal from undiluted cattle farm wastewater by the two-stage process of microalgae-based wastewater treatment. Bioresource Technology 2018; 264:311-318. http://dx.doi.org/10.1016/j.biortech.2018.05.085.
[24] Nogueira S., Souza J., Maia H., Saboya J., Farias W. Use of Spirulina platensis in treatment of fish farming wastewater. Revista Ciência Agronômica 2018; 49(4):599-606. https://dx.doi.org/10.5935/1806-6690.20180068.
[25] Pena A., Fontoura J., Trierweiler L., Gutterres M. Estudo de um consórcio de microalgas na remoção de nutrientes de efluentes de curtume. Revista eletrônica científica da UERGS 2017; 3(4):743-752. https://doi.org/10.21674/2448-0479.34.743-752.
[26] Silveira E., Wink M., Zappe A., Kist L., Machado Ê. Sistema integrado com microalgas e wetland construído de fluxo vertical no tratamento de efluentes urbanos. Engenharia Sanitaria e Ambiental 2019; 24(2):305-313. https://doi.org/10.1590/s1413-41522019161655
[27] Nascimento R., Fernandes M., Santana H., Cereijo C., Garcia L., Siqueira F., Brasil B. Avaliação do cultivo de microalgas em fotobiorreatores de placas planas para a produção de biomassa e biorremediação de efluente da agroindústria de óleo de palma. Processos Bioquímicos 2016; p. 103-109
[28] Ortiz-Villota M., Romero-Morales M., Meza-Rodríguez L. La biorremediación con microalgas (Spirulina máxima, Spirulina platensis y Chlorella vulgaris) como alternativa para tratar la eutrofización de la laguna de Ubaque, Colombia. Revista de Investigación, Desarrollo e Innovación 2018; 9(1):163-176. https://dx.doi.org/10.19053/20278306.v9.n1.2018.8153.
[29] Villar-Navarro E., Baena-Nogueras R., Paniw M., Perales J., Lara-Martín P. Removal of pharmaceuticals in urban wastewater: High rate algae pond (HRAP) based technologies as an alternative to activated sludge based processes. Water Research 2018; 139:19-29. https://doi.org/10.1016/j.watres.2018.03.072.
[30] Park J., Craggs R. Nutrient removal in wastewater treatment high rate algal ponds with carbon dioxide addition. Water Science & Technology 2011; 63(8):1758-1764. https://doi.org/10.2166/wst.2011.114.
[31] Arcila J., Buitrón G. Microalgae-bacteria aggregates: effect of the hydraulic retention time on the municipal wastewater treatment, biomass settleability and methane potential. Journal of Chemical Technology & Biotechnology 2016; 91(11). https://doi.org/10.1002/jctb.4901.
[32] Cerón V., Madera C., Peña M. Uso de lagunas algales de alta tasa para tratamiento de aguas residuales. Ingeniería y Desarrollo 2015; 33(1):98-125. https://dx.doi.org/10.14482/inde.33.1.5318.
[33] Gutiérrez R., Ferrer I., González-Molina A., Salvadó H., García J., Uggetti E. Microalgae recycling improves biomass recovery from wastewater treatment high rate algal ponds. Water Research 2016; 106(1):539-549. https://doi.org/10.1016/j.watres.2016.10.039.
[34] Aguirre P., Álvarez E., Ferrer I., García J. Treatment of piggery wastewater in experimental high rate algal ponds. Revista Latinoamericana de Biotecnología Ambiental y Algal 2011; 2(2):57-66.
[35] El Hamouri B. Rethinking natural, extensive systems for tertiary treatment purposes: The high-rate algae pond as an example. Desalination and water treatment 2009; 4(1-3):128-134. https://doi.org/10.5004/dwt.2009.367.
[36] Sukacová K., Cervený J. Can algal biotechnology bring effective solution for closing the phosphorus cycle? Use of algae for nutrient removal - review of past trends and future perspectives in the context of nutrient recovery. European Journal of Environmental Sciences 2017; 7(1):63-72. https://doi.org/10.14712/23361964.2017.6.
[37] Xu M., Bernards M., Hu Z. Algae-Facilitated chemical phosphorus removal during high-density Chlorella emersonii cultivation in a membrane bioreactor. Bioresource technology 2014; 153:383-387. https://doi.org/10.1016/j.biortech.2013.12.026.
[38] Mustafa E.M., Phang S.M., Chu W.L. Use of an algal consortium of five algae in the treatment of landfill leachate using the high-rate algal pond system. Journal of Applied Phycology 2012; 24(4):953-963. https://doi.org/10.1007/s10811-011-9716-x.
[39] Priya M., Gurung N., Mukherjee K., Bose S. Microalgae in Removal of Heavy Metal and Organic Pollutants from Soil. Microbial Biodegradation and Bioremediation 2014; 23:519-537. https://doi.org/10.1016/B978-0-12-800021-2.00023-6
[40] Sutherland D., Park J., Ralph P., Craggs R. Improved microalgal productivity and nutrient removal through operating wastewater high rate algal ponds in series. Algal Research 2020; 47:101850. https://doi.org/10.1016/j.algal.2020.101850
[41] Cho D., Choi J., Kang Z., Kim B., Oh H, Kim H., Ramanan R. Microalgal diversity fosters stable biomass productivity in open ponds treating wastewater. Scientific Reports 2017; 7:1979. https://doi.org/10.1038/s41598-017-02139-8.
[42] Craggs R., Lundquist T., Benemann J. Wastewater treatment and algal biofuel production. In: Borowitzka M., Moheimani N. (eds). Algae for Biofuels and Energy. Springer; 2013, p.153-163. Murdoch, Australia. https://doi.org/10.1007/978-94-007-5479-9.
[43] Kang D., Kim K., Heo T., Kwon G., Lim C., Park J. Inhibition of Photosynthetic Activity in Wastewater-Borne Microalgal-Bacterial Consortia under Various Light Conditions. Sustainability 2019; 11: 2951. https://doi.org/10.3390/su11102951.
[44] James I., Yoon L., Chow Y. Effect of phosphorus-limited nutrients on growth and glucose production from microalgae. AIP Conference Proceedings 2019; 2137:020005. https://doi.org/10.1063/1.5120981.
[45] Janssen M., de Bresser L., Baijens T., Tramper J., Mur L.R., Snel J.F.H., Wijffels R.H. Scale-up aspects of photobioreactors: Effects of mixing-induced light/dark cycles. Journal of Applied Phycology 2000; 12:225-237. https://doi.org/10.1023/A:1008151526680.
[46] Choi H., Lee S. Advances in microalgal biomass/bioenergy production with agricultural by-products: Analysis with various growth rate models. Environmental Engineering Research 2019; 24(2):271-278. https://doi.org/10.4491/eer.2018.193.
[47] Lee K., Lee C. Effect of Light/Dark Cycles on Wastewater Treatments by Microalgae. Biotechnology and Bioprocess Engineering 2001; 6(3):194-199
https://doi.org/10.1007/BF02932550.
[48] Durvasula R., Hurwitz I., Fieck A., Subba D. Culture, growth, pigments and lipid content of Scenedesmus species, an extremophile microalga from Soda Dam, New Mexico in wastewater. Algal Research 2015; 10:128-133. https://doi.org/10.1016/j.algal.2015.04.003.
[49] Zhu L. Biorefinery as a promising approach to promote microalgae industry: An innovative framework. Renewable & Sustainable Energy Reviews 2015; 41:1376-1384. https://doi.org/10.1016/j.rser.2014.09.040.
[50] Raposo M., Morais R., Morais A. Health applications of bioactive compounds from marine microalgae. Life Sciences 2013; 93:479-486. https://doi.org/10.1016/j.lfs.2013.08.002.
[51] Yaakob Z., Ali E., Zainal A., Mohamad M., Takriff M.S. An overview: biomolecules from microalgae for animal feed and aquaculture. Journal of Biological Research (Thessaloniki) 2014; 21:6 https://doi.org/10.1186/2241-5793-21-6.
[52] Guedes A., Amaro H., Malcata F. Microalgae as Sources of Carotenoids. Marine Drugs 2011; 9(4):625-644. https://doi.org/10.3390/md9040625.
[53] Dufossé L., Galaup P., Yaron A., Arad S., Blanc P., Chidambara K., Ravishankar G. Microorganisms and microalgae as sources of pigments for food use: a scientific oddity or an industrial reality? Trends in Food Science & Technology 2005; 16:389-406. https://doi.org/10.1016/j.tifs.2005.02.006.
[54] Borowitzka M. High-value products from microalgae-their development and commercialization. Journal Applied Phycology 2013; 25:743-756. https://doi.org/10.1007/s10811-013-9983-9.
[55] Ramírez-Mérida L.G., Zepka L.Q., Jacob-Lopes E. Why does the Photobioreactors Fail? Journal of Bioprocessing & Biotechniques 2015; 5:7. https://doi.org/10.4172/2155-9821.1000239.
[56] Ramírez-Mérida L.G., Zepka L.Q., Jacob-Lopes E. Current Status, Future Developments and Recent Patents on Photobioreactor Technology. Recent Patents Engineering 2015; 9(2):80-90. https://doi.org/10.2174/1872212109666150206235316.
[57] Cardozo K., Guaratini T., Barros M., Falcão V., Tonon A., Lopes N., Campos S., Torres M., Souza A., Colepicolo P., Pinto E. Metabolites from algae with economical impact. Comparative Biochemistry and Physiology - Part C: Toxicology & Pharmacology 2007; 146(1):60-78. https://doi.org/10.1016/j.cbpc.2006.05.007.
[58] Wan M., Zhang Z., Wang J., Huang J., Fan J., Yu A., Wang W., Li Y. Sequential Heterotrophy-Dilution-Photoinduction Cultivation of Haematococcus pluvialis for efficient production of astaxanthin. Bioresource Technology 2015; 198:557-563. https://doi.org/10.1016/j.biortech.2015.09.031.
[59] Pasquet V., Chérouvrier J., Farhat F., Thiéry V., Piot J., Bérard J., Kaas R., Serive B., Patrice T., Cadoret J., Picot L. Study on the microalgal pigments extraction process: performance of microwave assisted extraction. Process Biochemistry 2011; 46:59-67. https://doi.org/10.1016/j.procbio.2010.07.009.
[60] Chen C., Hsieh C., Lee D., Chang C., Chang J. Production, extraction and stabilization of lutein from microalga Chlorella sorokiniana MB-1. Bioresource Technol 2016; 200:500-505. https://doi.org/10.1016/j.biortech.2015.10.071.
[61] Chagas A., Rios A., Jarenkow A., Marcílio N., Ayub M., Rech R. Production of carotenoids and lipids by Dunaliella tertiolecta using CO2 from beer fermentation. Biochemistry 2015; 50(6):981-988. https://doi.org/10.1016/j.procbio.2015.03.012.
[62] Nobre B., Villalobos F., Barragán B., Oliveira A., Batista A., Marques P., Mendes R., Sovová H., Palavra A., Gouveia L. A biorefinery from Nannochloropsis sp. microalga - Extraction of oils and pigments. Production of biohydrogen from the leftover biomass. Bioresource Technology 2013; 135:128-136. https://doi.org/10.1016/j.biortech.2012.11.084.
[63] Streit N., Ramírez Mérida L., Zepka L., Jacob-Lopes E., Queiroz M. Producción de pigmentos por Aphanothece microscopica Nägeli a partir de resíduos industriales lácteos. Ingeniare 2017; Revista chilena de ingeniería 25(2):350-358. https://doi.org/10.4067/S0718-33052017000200350.
[64] Flassig R., Fachet M., Rihko-Struckmann L., Sundmacher K. Robust process design for the bioproduction of ?-carotene in green microalgae. Computer Aided Chemical Engineering 2015; 37:2117-2122.
[65] Rodrigues D., Flores É., Barin J., Mercadante A., Jacob-Lopes E., Zepka L. Production of carotenoids from microalgae cultivated using agroindustrial wastes. Food Research International 2014; 65(B):144-148. https://doi.org/10.1016/j.foodres.2014.06.037.
Autor
Luis Guillermo Ramírez Mérida*
Centro de Biotecnología Aplicada, Departamento de Biología, Universidad de Carabobo, Campus Bárbula. Naguanagua. Código postal 2005. Carabobo, Venezuela.
* Autor de correspondencia: lgramire@uc.edu.ve / luisguillermolgrm@gmail.com
