AGROBIOLOGÍA - Una visión general y sus aplicaciones
CAPÍTULO 3
Efecto de Trichoderma spp. sobre el desarrollo de plántulas de Capsicum annuum L. (pimentón) y el biocontrol del hongo fitopatógeno Sclerotium sp.
Elisa Peña-Tovar, Domenico Pavone-Maniscalco
http://dx.doi.org/10.4322/mp.2020.001.03
Resumen
El cultivo de pimentón es un rubro altamente influenciado por plagas y enfermedades, siendo el Sclerotium spp de los patógenos más problemáticos. Este trabajo pretende aportar metodologías biológicas para controlar esta enfermedad a través del uso del hongo antagonista Trichoderma sp. y promover su desarrollo. Se realizaron ensayos in vitro, enfrentando al patógeno con las cepas de Trichoderma spp. por separado y ensayos de vivero. En los enfrentamientos in vitro se obtuvo un control del patógeno superior al 90 % con todas las cepas de Trichoderma estudiadas. Asimismo, promovieron mayor desarrollo radical y foliar en las plantas. De esta forma, los datos sugieren un efecto benéfico de las cepas de Trichoderma spp sobre el desarrollo del cultivo del pimentón. Estudios más profundos a nivel de campo podrían corroborar estos efectos, convirtiendo así a Trichoderma en una alternativa a ser incorporada en los programas de manejo integrado
Palabras clave: Control biológico, T. asperellum, T. harzianum, T. reesei.
1. Introducción
La producción del pimentón (Capsicum annuum L.) es influenciada por factores bióticos y abióticos, siendo las plagas y enfermedades algunos de los más importantes, incluyendo: hongos como Phytophthora capsici, Rhizoctonia solani, Verticillium dahliae, Colletotrichum, Leveillula taurica, Fusarium spp., bacterias como Xanthomonas spp, virus, nemátodos e insectos [1]. En el Municipio Cocorote del Estado Yaracuy, Venezuela, se ha observado la presencia de una patología que afecta los rendimientos del pimentón. El agente causal de la sintomatología ha sido identificado como Sclerotium sp., siendo este género muy importante como enfermedad del pimentón [2]. Entre los tratamientos utilizados para controlar a este fitopatógeno está Trichoderma spp. [3] que además es capaz de ejercer efectos benéficos sobre la fisiología de plantas de C. anunn [4,5].
Las especies del género Trichoderma poseen varios mecanismos para ejercer su efecto benéfico sobre los cultivos, descritos por Benítez et al., [6]: (a) La competencia, ocurre entre dos organismos que requieren el mismo recurso y el uso por uno reduce la cantidad disponible para el otro. (b) El micoparasitismo, considerado uno de los principales mecanismos involucrados en el antagonismo de Trichoderma como agente biocontrolador, donde el antagonista desarrolla un crecimiento hacia el patógeno, cubriendo a este o formando estructuras similares a ganchos o apresorios en la superficie del hospedador que le permiten penetrar al interior del patógeno. (c) La antibiosis, un mecanismo que se da a través de la producción de pequeñas moléculas tóxicas volátiles o no, produciendo un efecto adverso sobre el desarrollo del patógeno. (d) Promoción del crecimiento vegetal, el cual se manifiesta desde las primeras fases de la plántula, y que le confiere mayores ventajas a la hora del trasplante. También, se asocia a las raíces de la planta proporcionándole un mayor vigor y crecimiento [7] y a la resistencia sistémica inducida contra patógenos en plantas, ya que aplicadas a la rizósfera, producen protección contra patógenos del suelo o foliares [8].
De esta forma, la aplicación de Trichoderma en el cultivo de pimentón podría ser una herramienta no solo para el control de hongos fitopatógenos en el cultivo, sino como tratamiento integral para aumentar los rendimientos. Este trabajo propone a los productores de pimentón, un tratamiento con base en Trichoderma spp. que les permita controlar al hongo fitopatógeno y aumentar sus rendimientos.
2. Materiales y Métodos
2.1. Material biológico
Se utilizaron tres aislados de Trichoderma spp, T. harzianum (TV72), T. asperellum (TV190) y T. reesei (TV219)identificadas molecularmente [9] y preservadas en el Centro de Biotecnología Aplicada, Departamento de Biología, FACYT-UC, Venezuela. También se utilizó un aislado de Sclerotium sp obtenido a partir de plantas de pimentón enfermas del Fundo La Pardillera, Municipio Cocorote, Estado Yaracuy, Venezuela. Todos los aislados son mantenidos en el laboratorio por subcultivo alternado en medio agar papa dextrosa (PDA) y suelo estéril. Finalmente, se utilizaron semillas de pimentón tipo California sin tratamiento químico, obtenidos a partir de frutos del mercado local.
2.2. Cultivos duales Trichoderma-Sclerotium
En placas de petri con medio PDA, se procedió a sembrar un esclerocio de Sclerotium sp en un extremo de la misma a 1,5 cm del borde y un disco con micelio y esporas de cada cepa Trichoderma spp por separado en el lado opuesto por quintuplicado. Se realizaron registros fotográficos de cada placa diariamente con una hoja de papel milimetrado como fondo para determinar las áreas de las colonias de cada hongo con el Programa ImageTool for windows v 3.0 (The University of Texas Health Science Center). Las mediciones se realizaron diariamente por una semana y se expresaron como el área de la colonia del patógeno (cm2).
2.3. Ensayos de vivero con C. annuum
En vasos plásticos de 250 mL de capacidad se procedió a sembrar semillas de C. annuum en tierra abonada estéril. Previamente a la siembra, las semillas fueron sumergidas por dos horas en una suspensión de cada cepa de Trichoderma spp. (107 esporas/mL) por separado. Posteriormente, se secaron al aire y se procedió a la siembra de las mismas. Una vez emergidas las plantas se realizaron reinoculaciones semanales de Trichoderma spp, aplicando 10 mL de una suspensión del hongo (106 esporas/mL) en la base de la planta. Los grupos de plantas así sembradas fueron usadas en los ensayos de vivero de biocontrol, resistencia, crecimiento y tolerancia a la sequía.
2.4. Biocontrol de Sclerotium sp en condiciones de vivero
A plantas de C. anuum con crecimiento de 30-40 días después de la siembra (dds) se les colocó dos esclerocios de Sclerotium sp en la base del tallo, previamente sumergidos en suspensiones de cada cepa de Trichoderma spp (106 esporas/mL) por separado. Se utilizaron 30 plantas por tratamiento y un control sin la aplicación de Trichoderma spp., donde los esclerocios fueron sumergidos en agua destilada. Diariamente se determinó el número de plantas infectadas.
2.5. Efecto de Trichoderma spp sobre el crecimiento de plantas de C. anuum
A las plantas de C. anuum se les determinó semanalmente la altura de la planta y número de hojas, y al final del ensayo la biomasa seca tanto radical como aérea. Las raíces fueron separadas del material edáfico a través de lavados con agua corriente. Para la medida de biomasa seca, cada planta fue colocada en estufa (60°C) por separado hasta peso constante. Los resultados se expresaron como altura (cm), biomasa seca aérea y radical (mg).
2.6. Análisis estadísticos
Los datos fueron analizados a través de un análisis de varianza (ANOVA) y de comparación de medias (Prueba de Tukey), para corroborar la presencia de diferencias significativas entre los tratamientos. Los datos que no cumplieron con los supuestos del ANOVA se les aplicaron una prueba no paramétrica de Kruskall-Wallis. Para ello se utilizó el programa Statistix v 7.0.
3. Resultados y Discusión
3.1. Cultivos duales Trichoderma-Sclerotium
El primer paso en la búsqueda de una cepa capaz de controlar a Sclerotium sp es el cultivo dual. Hay que destacar que un resultado de control positivo en esta prueba no es garantía de un control eficiente en campo, debido a que las condiciones ambientales no son las mismas. El desarrollo de ambos hongos sobre la placa establecerá una competencia por el espacio y recursos así como posibles efectos parasíticos y de antibiosis.
En la Tabla 1 se puede observar el crecimiento (área de la colonia) de Sclerotium sp en presencia de cepas de Trichoderma spp. En el control, el crecimiento de Sclerotium sp no está limitado por ningún factor más que los nutrientes del medio y el espacio disponible en la placa de petri. Antes de alcanzar los cuatro días de ensayo, las colonias de ambos hongos no han entrado en contacto, por lo que al analizar las áreas de las colonias de Sclerotium antes de alcanzar este tiempo, es posible verificar la acción de sustancias antagónicas volátiles o difusibles en el agar producidas por Trichoderma spp, si se observan disminuciones en el crecimiento del patógeno en comparación con el control sin Trichoderma spp.
A las 24 y 72 horas puede apreciarse que no se encontraron diferencias significativas para el área promedio de Sclerotium sp. Sin embargo, a partir de las 96 horas el crecimiento del patógeno se redujo en todos los tratamientos donde se confrontó con Trichoderma spp, siendo el área de la colonia en el control de 16,79 cm2 y con TV72, TV190 y TV219 de 7,63; 7,47 y 9,05 cm2, respectivamente; con diferencias significativas entre estos y el control (p=0). Una vez ocurrido el contacto entre las colonias, las disminuciones en el tamaño de Sclerotium sp, no pueden atribuirse en su totalidad a la producción de sustancias antagónicas volátiles o difundibles en el agar, debido a que otros parámetros físicos podrían estar involucrados.
Al final del ensayo (164 h) puede apreciarse que esta tendencia se mantiene, siendo las cepas TV72 y TV190, las que más inhibieron el crecimiento del patógeno. Para corroborar relaciones micoparasíticas entre los aislados es necesario realizar determinaciones adicionales como actividades enzimáticas relacionadas con el micoparasitismo, observación de enrollamiento de hifas al microscopio, entre otras.
Área de la colonia de Sclerotium sp (cm2) |
||||||
Cepa |
24h |
72h |
96h |
120h* |
144h* |
164h* |
Sc Control |
0,13±0,04a |
0,19±0,01a |
16,37±0,92a |
55,66±2,2a |
86,52±1,01a |
86,63±0,93ª |
Sc - TV72 |
0,29±0,14a |
0,65±0,2a |
7,63±1,78c |
12,45±0,86c |
12,22±1,77c |
10,38±1,46c |
Sc - TV190 |
0,17±0,03a |
0,7±0,13a |
7,47±1,05c |
15,20±1,66c |
12,76±0,77c |
8,91±1,4c |
Sc - TV219 |
0,3±0,29a |
0,84±0,22a |
9,05±1,71b |
31,87±7,83b |
27,03±5,82b |
46,97±10,31b |
| Tabla 1. Crecimiento de Sclerotium sp en placas con medio PDA enfrentado o no con Trichoderma spp. Los datos presentados son el promedio de cinco repeticiones y el error estándar. Los tratamientos con la misma letra no presentan diferencias significativas entre sí. (*)Colonias del patógeno y Trichoderma en contacto. |
Los mecanismos por los que las cepas del género Trichoderma spp desplazan al fitopatógeno no son excluyentes uno del otro sino que actúan sinérgicamente en el control de los patógenos [4]. Uno de los mecanismos más estudiados sobre el antagonismo de Trichoderma spp. es el micoparasitismo, durante el cual el antagonista se desarrolla a expensas del hongo patógeno [10]. Algunos autores señalan que tanto T. harzianun como T. asperelum presentan un sistema de producción de enzimas de tipo quitinolíticas (quitinasas y glucanasas), capaces de degradar los polisacáridos presentes en las paredes de los fitopatógenos logrando invadir sus tejidos y causando la estrangulación de sus estructuras reproductivas [11].
Los resultados de inhibición obtenidos concuerdan con lo reportado por Hoyos et al., [3], cuando lograron inhibir el crecimiento de los patógenos Rhizoctonia solani y Sclerotium rolfsii a los 7 y 8 días de tratamiento al realizar pruebas in vitro con 7 cepas de T. asperellum y 1 de T. longibrachiatum. Malhotra et al., [12] señala que el poder antagónico de T. harzianum frente al patógeno se produce poco después de ponerse en contacto con el antagonista, atribuyéndose esto al proceso de enrollado, seguido de una considerable producción de enzimas hidrolíticas (parámetros no determinados en este trabajo), que llevan a un proceso micoparasítico. Aunado a esto, Michele-Aceves et al., [13] indican que mientras mayor sea la concentración enzimática producida por los antagonistas mayor será el resultado inhibitorio de las cepas. Si se logra evidenciar un sinergismo positivo entre la actividad gluconolitica y quitinoliticas mayor será el poder de Trichoderma en degradar las paredes de los patógenos.
La forma en que Trichoderma probablemente inhibe el crecimiento radial, aun estando a distancia del patógeno, está mediada por diversos mecanismos, destacándose la producción de compuestos inhibitorios al medio o volátiles, tal como lo sugieren Duran et al., [14].
T. asperellum ha sido reportado como un excelente antagonista de muchos hongos patógenos, reportándose la producción de enzimas de tipo quitinolíticas, 1,3-glucanasas, 1,6-glucanasas, celulasas y proteasas [15]. Este hongo también puede inducir resistencia sistémica contra patógenos foliares y colonizar endofíticamente la epidermis y la corteza exterior de las radículas o de tallos y hojas [7], quienes demostraron el poder antagónico de T. asperellum frente a patógenos como R. solani y Botrytis cinerea, logrando inhibir su crecimiento en un 70% y 100% en tan solo 72 horas.
A pesar que Trichoderma reesei no ha sido reportado como un hongo antagonista de fitopatógenos, sino más bien un gran productor de enzimas celulasas para la industria [16], nuestros ensayos mostraron que es capaz de inhibir el crecimiento de Sclerotium sp durante las primeras 96 horas, disminuyendo el desarrollo del patógeno. Sin embargo, esta capacidad de inhibición no fue tan marcada como en TV72 y TV190.
3.2. Efecto de Trichoderma spp. sobre el crecimiento de plantas de C. anuum
Diversos factores son los que influyen en el crecimiento y desarrollo de las plantas, siendo Trichoderma spp capaz de promoverlo [5], especialmente los relacionados al incremento en el crecimiento tanto del tipo foliar como radical y mejorando sus rasgos fisiológicos [17].
Los resultados del crecimiento de plantas de pimentón con presencia o no de Trichoderma spp, se muestran en las Figuras 1, 2 y 3. En la Figura 1, puede apreciarse los resultados referentes a la altura de la planta luego de 5 semanas de estudio, siendo los tratamientos con las tres cepas de Trichoderma spp, los que mejores resultados arrojaron en comparación con el control. Así, los valores de crecimiento de las plantas de C. annuum fueron de 3,43; 3,67; 3,23 y 2,23 para TV72, TV190, TV219 y el control, respectivamente; con diferencias significativas entre TV72 y TV190 con el control (P=0,0066).
En la Figura 2, se muestran los resultados obtenidos de biomasa seca radical de C. annuum, cuando es crecida en presencia o no de Trichoderma spp, evidenciándose el efecto positivo del antagonista sobre las plantas, siendo la cepa con mayor efecto la TV190 con 14,66 mg; seguida de TV72 con 10,5 mg; TV219 con 9,85 mg y el control con 7 mg, existiendo diferencias significativas entre los tratamientos (p=0). En el caso de la biomasa aérea (Figura 3), aunque el mayor valor se encontró usando la cepa TV190 (17,5 mg) en comparación con el control (12,1 mg), no se encontraron diferencias significativas entre los tratamientos (p=0,25).
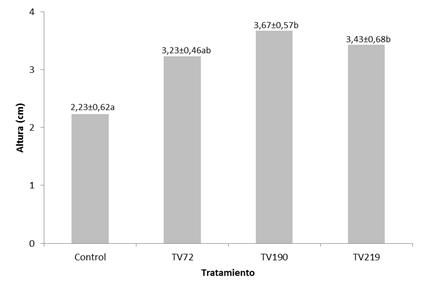
| Figura 1. Efecto de Trichoderma spp sobre la altura de las plantas de C. annuum. Los tratamientos con la misma letra no son significativamente distintos entre sí. TV72: T. harzianum, TV190: T. asperellum, TV219: T. reesei. |
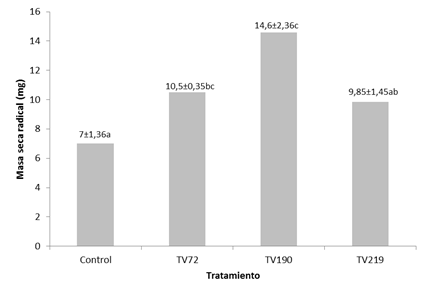
| Figura 2. Efecto de Trichoderma spp en el peso de las raíces de las plantas de C. annuum. Los tratamientos con la misma letra no son significativamente distintos entre sí. TV72: T. harzianum, TV190: T. asperellum, TV219: T. reesei. |
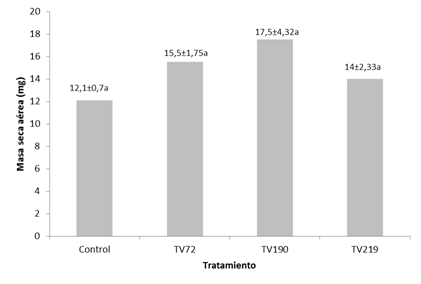
| Figura 3. Efecto de Trichoderma spp en el peso de las hojas y tallos de las plantas de C. annuum. Los tratamientos con la misma letra no son significativamente distintos entre sí. TV72: T. harzianum, TV190: T. asperellum, TV219: T. reesei. |
Se ha demostrado que la aplicación de T. harzianum con compost orgánico logra incrementar en gran medida la masa foliar y la altura de plantas de pino [18], además de generar un mayor desarrollo en la parte radical de las plantas. Esto indica que T. harzianum puede estar modulando la respuesta en esta especie a la presencia de compost, lo que podría ser explicado por un aumento del desarrollo radicular que permite a las plantas aprovechar la disponibilidad de nutrientes. Otros autores señalan que T. harzianum es capaz de producir sideróforos que pudieran coadyuvar en el incremento de la altura y biomasa de las plantas [19].
Infante et al., [20] probaron 11 aislados de T. asperellum sobre Curvularia, Bipolaris y Fusarium, los cuales presentaron una eficacia superior al 80% afectando al menos dos de los fitopatógenos, mientras que los aislamientos T.1 y T.90 mostraron más del 90% de eficacia sobre los tres fitopatógenos. Estos resultados evidencian, que la selección de la cepa es un elemento importante para el manejo de enfermedades. Algunos compuestos producidos por T. asperellum han sido utilizados en diversas tipos de plantas con la finalidad de observar su desarrollo y el efecto controlador de enfermedades radicales. En plantas de olivo tratadas con un producto conocido como Bioten® compuesto por una mezcla de T. asperellum y T. gamsii, lograron obtener plantas con un mayor desarrollo radical en cuanto a la robustez de las mismas, logrando así reducir la enfermedad causada por Verticillium dahliae en un 30% [21]. Los efectos de este antagonista pueden reflejarse en distintas etapas de los cultivos y en diversas plantas de la familia Solanaceas, logrando un incremento tanto en el desarrollo foliar como radical de las plantas en un 84,5% con respecto a las plantas control [22]. Este incremento foliar posiblemente es debido a que T. asperellum se concentra en la parte radical de la planta logrando que las raíces vigorosas tomen más eficientemente los nutrientes y su translocación a partes aéreas de la planta. Casanova et al., [23] demostraron que una cepa de T. asperellum (T34) actúa como promotor del crecimiento al ser aplicado en semillas de pimentón, logrando incrementar la biomasa de las plantas en un 90% y aplicado en semillas de tomate incrementó en un 60% el desarrollo de las plántulas.
En este trabajo, la mayor masa seca radical y foliar la presentaron las plantas tratadas con los antagonistas T. harzianum y T. asperellum, evidenciando de esta forma el poder que poseen los mismos en desarrollar el crecimiento de las plantas.
3.3. Biocontrol de Sclerotium sp en condiciones de vivero
La capacidad biocontroladora del género Trichoderma spp ha venido estudiándose ampliamente en diversos cultivos agrícolas, comprobando la variedad de adaptación y desarrollo que presentan en las variadas condiciones en las que se desenvuelven. Durante los experimentos de este trabajo, todas las cepas presentaron capacidad biocontroladora (Tabla 2), donde puede apreciarse que con la cepa TV72 (T. harzianum) no se observó ninguna planta infectada y con TV190 (T. asperellum) solo se observó una planta infectada. Para las plantas tratadas con la cepa TV219 pertenecientes a T. reesei también se obtuvo un efecto controlador de la enfermedad pero en menor proporción con solo 4 plantas infectadas.
Tratamiento |
Nº de plantas infectadas |
% de infección |
Control |
11 |
36 |
TV72 |
0 |
0 |
TV190 |
1 |
3,33 |
TV219 |
4 |
13,33 |
| Tabla 2. Efecto de Trichoderma spp en el biocontrol de Sclerotium sp en plántulas de pimentón. |
Hoyos et al., [22] obtuvieron resultados similares al controlar Sclerotium rolfsii con diversas cepas de T. asperellum, encontrando una disminución de la enfermedad causada por este patógeno en plantas de frijol desde un 47% hasta un 100% de inhibición. Así, las condiciones de desarrollo de las plantas conferidas por el sustrato pueden influir en el desarrollo tanto del patógeno como del antagonista. Guigon et al., [24] señalan que la capacidad biocontroladora de Trichoderma spp está ligada al tamaño del inóculo del patógeno y a la rapidez de desarrollo que este tenga, ya que logra colonizar con mayor rapidez los tejidos de la planta. Estos autores lograron inhibir en 70% la enfermedad causada por Phytophthora capsisi en plantas de pimiento en aquellas que la densidad del inóculo estaba por debajo de una concentración de 1,2x106 esp/mL y en donde el tratamiento con Trichoderma spp fue aplicado desde la etapa de semilla de las plantas.
El desarrollo y la eficiencia de Trichoderma spp depende también en gran medida del tipo de sustrato y las condiciones en las que se desarrolla, mientras mayor sea la colonización de este en las zonas radicular de la planta mayor será el efecto de biocontrol a nivel de campo. Es por ello que Trillas et al., [25], señalan que la eficiencia de T. asperellum se incrementa al ser aplicado junto con un sistema de composta en los cultivos, que cuando son evaluados a nivel de campo se encontró un 70 y 80% de efectividad del antagonista.
También es importante señalar que mientras mayor sea la aplicación de los antagonistas al medio, mayor será la capacidad de controlar la enfermedad. Durante nuestros ensayos se realizó la aplicación de las cepas de los antagonistas semanalmente durante 5 semanas, logrando garantizar el desarrollo de los mismos en el sustrato. Correa et al., [26], señalan que lograron inhibir el desarrollo de Sclerotium rolfsii en plantas de soya entre 40% y 100%. De igual forma hay que tener presente el hecho de que la capacidad biocontroladora de los antagonistas del género Trichoderma spp puede variar con la cepa utilizada y con su adaptabilidad a las condiciones bióticas y abióticas, así como también presentar grados de selectividad contra diferentes hongos patógenos en cultivos agrícolas.
Un trabajo interesante realizado por Ros et al., [27], evidenciaron que un compost fortificado con T. asperellum fue el más efectivo comparado con otras cepas de Trichoderma, contra Phytophthora nicotianae en plántulas de pimentón. El efecto del compost fortificado fue más alto que el del compost solo. Los autores sugieren que el efecto de biocontrol debería ser atribuido a las cepas de Trichoderma más a que la microbiota del compost, aunque algunos microorganismos pudieran ayudar en el efecto de biocontrol.
4. Conclusiones y Recomendaciones
Las cepas utilizadas durante los ensayos lograron suprimir el desarrollo del patógeno Sclerotium sp in vitro y en plántulas de pimentón en condiciones de vivero. Las cepas T. asperellum y harzianum fueron los mejores tratamientos para lograr el biocontrol de Sclerotium sp, inhibiendo la enfermedad hasta en un 100%. T. asperelum además de ser un buen antagonista, también logró promover los mayores incrementos en el crecimiento de las plántulas. A pesar de que T. reesei no ha sido reportado como un biocontroldor efectivo, sino como productor de enzimas celulasas, los hallazgos sugieren que si posee alguna capacidad de suprimir a Sclerotium sp. El estudio de un mayor número de cepas así como ensayos de campo determinando rendimientos, son necesarios para conocer la factibilidad del uso de Trichoderma spp como una herramienta dentro de los programas de manejo integrado de plagas y enfermedades.
5. Referencias
[1] Parisi M., Alioto D., Tripodi P. Overview of biotic stresses in pepper (Capsicum spp.): Sources of genetic resistance, molecular breeding and genomics. International Journal of Molecular Science 2020; 21(7): 2587. https://doi.org/10.3390/ijms21072587.
[2] Reyes R., Martínez B., Rivero G., Montejo G. Actividad in vivo de Trichoderma harzianum sobre Sclerotium rolfsii en plántulas de tomate. Manejo Integrado de Plagas y Agroecología 2002; 66: 45-48.
[3] Hoyos L., Chaparro P., Abramsky M., Chet L., Orduz S. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Agronomía Colombiana 2008; 26 (3): 451-458. https://revistas.unal.edu.co/index.php/agrocol/article/view/11477/12123.
[4] Harman G. Myths and dogmas of Biocontrol, Changes in perceptions derived from research on Trichoderma harzianum T-22. Plant Disease 2000; 84(4): 377-393. https://doi.org/10.1094/PDIS.2000.84.4.377.
[5] Capuz R. Control biológico de Trichoderma asperellum sobre Sclerotium rolfsii en condiciones de invernadero. Revista online de la Universidad de Guayaquil 2010; 109: 36. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092009000100003&lng=es&tlng=es.
[6] Benítez T., Rincón A., Limón M., Codón A. Biocontrol mechanisms of Trichoderma strains. International Microbiology 2004; 7: 249-260. http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1139-67092004000400003&lng=es.
[7] López-Bucio J., Pelagio-Flores R., Herrera-Estrella A. Trichoderma as biostimulant: exploiting the multilevel properties of a plant beneficial fungus. Scientia Horticulturae 2015; 19630: 109-123. https://doi.org/10.1016/j.scienta.2015.08.043.
[8] Nawrocka J., Malolepsza U. Diversity in plant systemic resistance induced by Trichoderma. Biological Control 2013; 67(2): 149-156. https://doi.org/10.1016/j.biocontrol.2013.07.005.
[9] Pavone D., Dorta B. Diversidad del hongo Trichoderma spp. en plantaciones de maíz de Venezuela. Interciencia 2015; 40(1): 23-31. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S1315-25562015000100008&lng=es.
[10] Carsolio C., Benhamou N., Haran S., Cortes C., Gutierrez A., Chet I.,Herrera E. Role of Trichoderma harzianum endochitinase gene, ech42, in mycoparasitism. Applied and Environmental Microbiology 1999; 65: 929-935. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC91125/.
[11] Mendoza-Mendoza A., Zaid R., Lawry R., Hermosa R., Monte E., Horwitz B., Mukherjee P. Molecular dialogues between Trichoderma and roots: Role of the fungal secretome. Fungal Biology Reviews 2018; 32 (2): 62-85. https://doi.org/10.1016/j.fbr.2017.12.001.
[12] Malhotra A., Agarwal T., Trivedi P. In vitro efficacy of various fungal and bacterial antagonists against Rhizoctonia solani, causal agent of damping off disease in Capsicum annuum L. Internartional Journal of Pharma and Bio Sciencies 2011; 2(3): 288-292.
[13] Michel-Aceves A.; Otero-Sánchez M., Rebolledo-Domínguez O., Lezama-Gutiérrez R., Ochoa-Moreno M. Producción y efecto antagónico de quitinasas y glucanasas por Trichoderma spp, en la inhibición de Fusarium subglutinans y Fusarium oxysporum in vitro. Revista Chapingo Serie Horticultura [Internet]. 2005; 11(2):273-278. Recuperado de: https://www.redalyc.org/articulo.oa?id=60911213.
[14] Durán E., Robles F., Martínez J., Brito M. Trichoderma sp un hongo combatiente de patógenos. Revista Técnico Ambiental Teorema Ambiental 2003; 42: 23-26.
[15] Marcello C., Steindorff A., Silva S., Silva R., Mendes B., Ulhoa C. Expression analysis of the exo-b-1,3-glucanase from the mycoparasitic fungus Trichoderma asperellum. Microbiological Research 2010; 165: 75-81. https://doi.org/10.1016/j.micres.2008.08.002.
[16] Kumar Gupta V., Stecca Steindorff A., Graciano de Paula R., Silva-Rocha R., Mach-Aigner A., Mach R., Silva R. The post-genomic era of Trichoderma reesei: What's next? Trends in Biotechnology 2016; 34(12) 970-982. https://doi.org/10.1016/j.tibtech.2016.06.003.
[17] Vinale F., Sivasithamparam K., Ghisalberti E., Ruocco M., Wood S., Lorito M. Trichoderma secondary metabolites that affect plant metabolism. Nat Prod Commun. 2012; 7(11): 1545-50. https://pubmed.ncbi.nlm.nih.gov/23285827/.
[18] Donoso E., Lobos G., Rojas N. Efecto de Trichoderma harzianum y compost sobre el crecimiento de plántulas de Pinus radiata en vivero. Bosque 2008; 29(1): 52-57. http://dx.doi.org/10.4067/S0717-92002008000100006.
[19] Altomare C., Norvell W., Bjokman J., Harman G. Solubilization of phosphates and micronutrients by the plant-growth promoting and biocontrol fungus Trichoderma harzianum Rifai. Applied Environmental Microbiology1999; 65: 2926-2933. https://pubmed.ncbi.nlm.nih.gov/10388685/.
[20] Infante D., González N., Reyes Y., Martínez B. Evaluación de la efectividad de doce cepas de Trichoderma asperellum Samuels sobre tres fitopatógenos en condiciones de campo. Revista Protección Vegetal 2011; 26(3): 194-197.
[21] Jiménez R., Trapero J., Boned J., Landa B., Navas J. Uso de Bioten para la protección biológica de plantones de olivo contra la verticilosis causada por el patotipo defoliante de Verticillium dahliae. Boletin de Sanidad Vegetal Plagas 2009; 35:595-615.
[22] Hoyos L., Jaramillo S., Orduz S.. Evaluación de Trichoderma asperellum como biorregulador de Spongospora subterranea f. sp. subterránea. Revista Facultad de Agronomía Medellín 2008; 61(2): 4496-4502. https://revistas.unal.edu.co/index.php/refame/article/view/39913.
[23] Casanova E., Sánchez P., Segarra G., Borrero C., Aviles Trillas M. Beneficios del uso en la agricultura de agentes de control biológico Trichoderma asperellum cepa T34. Departamento de Biología Vegetal. Universidad de Barcelona. 2005; 14-20. Disponible en https://www.academia.edu/28119834/BENEFICIOS-DEL-USO-EN-LA-AGRICULTURA-DE-AGENTES-DE-CONTROL-BIOL%C3%93GICO.-Trichoderma-asperellum-cepa-T34. Accesado 18 de mayo de 2020.
[24] Guigon C., & González P. Selección de cepas nativas de Trichoderma spp. con actividad antagónica sobre Phytophthora capsici leonina y promotoras de crecimiento en el cultivo de chile (Capsicum anuum L.). Revista Mexicana de Fitopatología 2004; 22(1): 117-124. https://www.redalyc.org/pdf/612/61222115.pdf.
[25] Trillas I., Casanova E., Cotxarrera L., Ordovas J., Borrero C., Avilés M. Composts from agricultural waste and the Trichoderma asperellum strain T-34 suppress Rhizoctonia solani in cucumber seedlings. Biological Control 2006; 39:32-38. https://doi.org/10.1016/j.biocontrol.2006.05.007.
[26] Correa S., Mello M., Avila Z., Minare B., Padua R., Gomes D. Cepas de Trichoderma spp. para el control biológico de Sclerotium rolfsii sacc. Fitosanidad 2007; 11(1): 3-9. https://www.redalyc.org/pdf/2091/209116144001.pdf.
[27] Ros M., Raut I., Santisima-Trinidad A., Pascual J. Relationship of microbial communities and suppressiveness of Trichoderma fortified composts for pepper seedlings infected by Phytophthora nicotianae. PLoS ONE 2017; 12(3): e0174069. https://doi.org/10.1371/journal.pone.0174069.
Autores
Elisa Peña-Tovar, Domenico Pavone-Maniscalco*.
Centro de Biotecnología Aplicada. Departamento de Biología. Facultad de Ciencias y Tecnología. Universidad de Carabobo. Campus de Bárbula. Naguanagua. Código postal 2005. Carabobo, Venezuela.
*Autor de correspondencia: dfpavone@yahoo.it
