Produtos Lácteos: Desenvolvimento & Tecnologia
CAPÍTULO 5
Estudo das características de potencial probiótico de bactérias ácido-láticas isoladas de Kefir produzido artesanalmente
Alice de Souza Ribeiro, Leidi Daiana Preichardt, Neila Silvia Pereira dos Santos Richards
https://doi.org/10.4322/mp.978-65-991393-2-1.c5
Resumo
Foram analisadas oito amostras de kefir produzidos artesanalmente na região noroeste do Estado do Rio Grande do Sul, Brasil. As amostras coletadas foram cultivadas em laboratório e de cada amostra foram realizadas contagens de bactérias ácido-láticas e isoladas cinco colônias. Posteriormente foram realizados testes fenotípicos de morfologia, coloração de Gram e catalase. Os isolados que apresentaram características de bactérias ácido-láticas foram submetidas aos testes de atividade antagônica frente a bactérias patogênicas, resistência a sais biliares e condições de pH ácido. Com a realização deste trabalho, foi possível observar que o kefir artesanal cultivado e consumido na região de estudo tem características semelhantes entre as diferentes amostras, onde os isolados apresentaram um incipiente potencial probiótico. No entanto, sugerem-se mais estudos, especialmente em relação ao comportamento microbiológico para avaliar detalhadamente parâmetros que classifique esse alimento como funcional.
Palavras-Chave: Antagonismo, legislação, probiótico, resistência a pH ácido, resistência a sais biliares.
1. Introdução
Nas últimas décadas, as exigências dos consumidores de alimentos mudaram consideravelmente. Os consumidores acreditam cada vez mais que os alimentos contribuem diretamente para a sua saúde [1, 2]. Alimentos hoje não se destinam apenas em satisfazer a fome e fornecer os nutrientes necessários aos seres humanos, mas também, para prevenir doenças relacionadas à nutrição e melhorar o físico e o bem-estar mental dos consumidores [3, 4, 5]. Desta forma, os alimentos funcionais desempenham um papel importante no aumento da procura destes produtos devido ao aumento do custo dos cuidados de saúde, o aumento constante da expectativa de vida e do desejo das pessoas com idade mais avançada de melhorar sua qualidade de vida [6, 7, 8]. Apesar dos benefícios a saúde devido à ingestão de alguns alimentos já ser conhecido há muito tempo, os estudos sobre esses alimentos, denominados de funcionais, é recente.
O kefir é um produto lácteo com característica única, em virtude da combinação do ácido láctico e fermentação alcoólica da lactose no leite. É produzido pela atividade microbiana simbiótica dos grãos de kefir que têm um equilíbrio relativamente estável e específico de bactérias do ácido láctico e leveduras [9, 10]. O leite é fermentado com uma microbiota mista confinada a uma matriz de grãos de kefir descontínuos, que são recuperados depois da fermentação [11].
Diversos autores têm relatado os benefícios que esse produto apresenta, dentre eles: redução dos efeitos de intolerância à lactose, imunomodulação, proteção contra microrganismos patogênicos, balanço da microbiota intestinal, atividade anticarcinogênica, regeneração hepática, entre outros. Da mesma forma, é constatado que até os dias de hoje o consumo do kefir na sua forma microbiana clássica, não demonstrou características patogênicas e foi capaz de suprimir o crescimento de alguns patógenos como Salmonella e Shigella [12, 13].
O kefir ainda hoje é utilizado no Brasil como um produto da medicina popular, tendo hoje diversos efeitos probióticos relacionados à sua utilização. As características do produto dependem do tipo de substrato (leite) utilizado, do processo de produção e da composição de microrganismos presente nos grãos [14]. No entanto, o kefir, como bebida fermentada, tem divulgação recente no Brasil, em 2018 começou sua comercialização, até então, sua fabricação e consumo eram exclusivamente artesanais, sendo obtido pela fermentação do grão em leite ou em água adicionada de açúcar mascavo.
A maioria das pessoas em nosso país desconhece o produto, bem como os possíveis benefícios da inclusão deste alimento probiótico na dieta [14, 15]. Existe legislação específica para o kefir, o Artigo 386 do Decreto nº 9.013, de março de 2017 (RIISPOA) define leites fermentados, o que inclui o kefir, como produtos lácteos ou produtos lácteos compostos obtidos por meio da coagulação e da diminuição do pH do leite ou do leite reconstituído por meio da fermentação láctea, mediante ação de cultivos de microrganismos específicos, com adição ou não de outros produtos lácteos ou de substâncias alimentícias, sendo considerados leites fermentados o iogurte, o leite fermentado ou cultivado, o leite acidófilo ou acidofilado, o kumys, o kefir e a coalhada [16].
A Instrução Normativa nº 46, de 23 de outubro de 2007 estabelece a definição de kefir como o leite fermentado cuja fermentação se realiza com cultivos acido-lácticos elaborados com grãos de Kefir, Lactobacillus kefir, espécies dos gêneros Leuconostoc, Lactococcus e Acetobacter com produção de ácido láctico, etanol e dióxido de carbono. Os grãos de Kefir são constituídos por leveduras fermentadoras de lactose (Kluyveromyces marxianus) e leveduras não fermentadoras de lactose (Saccharomyces omnisporus e Saccharomyces cerevisae e Saccharomyces exiguus), Lactobacillus casei, Bifidobaterium sp e Streptococcus salivarius subsp thermophilus [17].
Algumas empresas já comercializam a cultura starters liofilizadas de kefir contendo bactérias ácido-láticas (BALs) como Lactococcus lasctis subsp., Leuconostoc sp., Lactobacillus sp., Streptococcus thermophillus, microflora de grãos de kefir e leveduras [18].
As BALs são encontradas em abundância no kefir e constituem sua microbiota natural. Trata-se de um grupo de microrganismos Gram-positivos comumente utilizados na indústria de laticínios na elaboração de produtos lácteos fermentados, como queijos e iogurtes [19, 20]. Produzem um grande número de enzimas glicolíticas, proteolíticas e lipolíticas, transformando os nutrientes do meio em compostos com propriedades sensoriais complexas, os quais modificam gradativamente a textura e o aroma dos alimentos fermentados [21, 22, 23].
Atividades antagônicas de cepas probióticas são essenciais para prevenir a infecção ou invasão de bactérias patogênicas. As cepas do gênero Bacillus, por exemplo, são conhecidas por produzir uma ampla gama de substâncias antimicrobianas, incluindo antibióticos peptídicos e lipopeptídicos [24, 25]. É reconhecido o papel da alimentação na promoção da saúde e proteção contra doenças. A comunidade científica já reconhece que os efeitos da alimentação inadequada em etapas precoces da vida podem acarretar consequências na saúde na vida adulta [26, 27].
Desta forma, este trabalho tem como objetivos estudar as características do kefir produzido na região Noroeste do Estado do Rio Grande do Sul, a fim de estabelecer uma identidade inicial da “house flora” dos grãos de kefir, avaliando seu potencial probiótico, através de teste de antagonismo frente a bactérias patogênicas e testes de resistência a condições ácidas e sais biliares, para selecionar cepas que servirão de starter na elaboração de produtos lácteos funcionais.
2. Materiais e Métodos
2.1. Matérias-primas
Foram coletadas oito amostras de kefir, oriundas de produção caseira da região noroeste do estado do Rio Grande do Sul.
Fabricação do leite fermentado:
A fabricação dos leites fermentados foi feita no laboratório de microbiologia do IF Farroupilha – Câmpus Santo Augusto. Para a fabricação dos mesmos, utilizou-se leite integral UHT (Santa Clara®) a temperatura ambiente (25±2 ºC). Em ambiente asséptico o leite foi transferido para oito shots e, inoculou-se assepticamente os grãos das amostras de kefir na proporção de 10% do volume de leite. Em seguida, as amostras (leite + grãos de kefir) foram incubadas em estufa a 27 °C em over night (aproximadamente 12 horas), até pH 4,5, monitorando através de medida em potenciômetro digital de hora em hora, após as 8 primeiras horas de fermentação.
2.1.1. Determinação da atividade antagonista das BALs frente a microrganismos patogênicos
A partir dos 8 isolados de bactérias láticas foram coletadas cinco colônias aleatoriamente totalizando quarenta alíquotas, estas foram purificadas em ágar MRS (Oxoid®) e avaliadas quanto à morfologia, coloração de Gram e catalase. Posteriormente, os isolados identificados como Gram positivos e catalase negativa, foram transferidos para caldo MRS (Oxoid®), onde foram cultivadas por 18 – 24h e, ainda com a cultura fresca, foi realizada a determinação da atividade antagonista [28].
A atividade antagonista foi testada frente a linhagens de referência Gram positivas: Listeria monocytogenes ATCC 7466 e Staphylococcus aureus ATCC 1901, bem como Gram negativas: E. coli ATCC 8739, Salmonella typhimurium ATCC 13076 e Salmonella enteritidis ATCC 13076.
O teste de antagonismo e a leitura dos halos de inibição foram realizados de acordo com o teste da gota (spot-on-the-lawn) proposto por Jacobsenet al. [29]. Uma alíquota de 5 μL de cada cultivo, em caldo MRS (Oxoid®), foi inoculada, em forma de gotas, em placas contendo ágar MRS (Oxoid®). Após a absorção das gotas, as placas foram incubadas a 35 ºC em jarra de anaerobiose por 24 h. Decorrido este período, cada placa recebeu uma sobrecamada de 10 mL de ágar BHI (Oxoid®) semi-sólido (0,8%) contendo aproximadamente 106 UFC/mL da cultura de referência previamente cultivada em caldo BHI (Oxoid®) por 24 h. Após a solidificação do meio, as placas foram incubadas, em aerobiose, a 35 ºC por 24 h. O resultado positivo para atividade antagonista em relação à cultura de referência e controle positivo foi determinado pela formação de halo de inibição. O diâmetro dos halos foi medido utilizando um paquímetro digital 200 MM-8” (Marca Marberg® – China).
2.1.2. Resistência a condições ácidas e sais biliares
A resistência dos isolados sob diferentes condições ácidas foi utilizada como critério de seleção dos isolados mais resistentes para realização sequencial dos demais experimentos, já que inicialmente as BALs probióticas devem resistir às condições ácidas estomacais. Ressalta-se que esta é uma condição essencial quando os micro-organismos não são protegidos por meio de encapsulação. Assim, a resistência dos isolados foi avaliada em caldo MRS (pH 6,5) (Oxoid®) ajustado a pH 2 e 2,5 com HCl concentrado e, ainda, a pH 2,5 + pepsina (Sigma®) (3 mg/mL).
A avaliação da tolerância bacteriana a sais biliares foi realizada em caldo MRS (Oxoid®) suplementado com bile bovina (Sigma®) a 0,3% e 1,0% (m/v). Após preparação dos caldos, conforme tratamentos mencionados anteriormente, culturas de 24 h com concentração final entre 106 e 107 UFC/mL foram inoculadas. A sobrevivência sob diferentes condições foi avaliada por contagem em placas com limite de detecção de 1,7 log10 UFC/mL, ambas as avaliações seguiram o protocolo de Perelmuter et al. [30]. O percentual de sobrevivência dos isolados frente às diferentes condições ácidas e aos sais biliares foi calculado com base nas contagens de células viáveis iniciais, anterior ao período de incubação.
3. Resultados e Discussão
3.1. Isolamento
Foram selecionadas e purificadas 40 colônias características de BALs das placas de ágar MRS utilizadas para o isolamento. Destas, 100% sobreviveram e foram submetidas à caracterização morfológica e teste da catalase. Observou-se, então, que todos os isolados apresentaram morfologia de cocobacilo, Gram positivos e catalase negativos.
Segundo Moraes et al. [31], a população microbiana de cada produto lácteo varia de acordo com a região geográfica onde este é produzido, podendo ser atribuídas variações em razão do leite utilizado, do clima predominante e dos métodos empregados no processamento. Sabe-se que a microbiota nativa encontrada em produtos provenientes de fermentação natural de alimentos de origem animal é bastante diversificada.
3.1.1.Determinação da atividade antagonista das BALs frente a microrganismos patogênicos
Foram testados cinco isolados de cada amostra, conforme Tabela 1, onde foi possível observar a formação de halos de inibição em todos os isolados. Os resultados demonstram que a sensibilidade às substâncias produzidas pelas bactérias lácticas e liberadas no meio extracelular varia de acordo com o patógeno e com o isolado do kefir. Muitas espécies de BALs são capazes de produzir uma variedade de compostos antimicrobianos, como ácidos orgânicos, dióxido de carbono, etanol, polissacarídeos e bacteriocinas que apresentam potencial no controle de patógenos e bactérias de deterioração durante a produção e armazenamento dos alimentos [32].
A ação antagonista de BALs nativas já foi descrita por diversos autores [33, 34, 35, 36, 37], principalmente em relação a patógenos Gram positivos. A presença da dupla camada lipídica (membrana externa) de bactérias Gram negativas impede a interação das substâncias antagonistas específicas, como bacteriocinas, com a parede e a membrana plasmática. Porém, outros trabalhos demonstram a existência de BALs nativas com potencial antagônico também contra patógenos Gram negativos [35, 38].
As médias dos halos de inibição observadas frente ao Clostridium sp., Salmonella typhimurium, Salmonella enteritidis, Listeria monocytogenes e Staphylococcus aureus foram, respectivamente 19,76 mm, 26,38 mm, 25,60 mm, 19,57 mm e 20,67 mm. A diferença nas medidas dos halos de inibição dos isolados é sugestiva de que os micro-organismos pertencem a diferentes espécies ou linhagens, onde houve variação inclusive em cepas isoladas da mesma amostra de leite fermentado.
Em estudos similares, Santos et al. [39], trabalhando com microrganismos de grãos de kefir, isolaram Lactobacillus com atividade antimicrobiana contra E. coli, L. monocytogenes, S. typhimurium e S. enteritidis observaram maiores halos de inibição contra L. monocytogenes. Já Dias [40], em estudo similar obteve maiores halos de inibição contra Salmonella enteriditis, enquanto no presente estudo foi observado maiores halos de inibição das cepas de BALs isoladas frente à bactéria Salmonella typhimurium, o que pode ser justificado pela ampla diversidade dessas bactérias, que se diferenciam pelo modo de cultivo, origem geográfica, entre outros fatores.
3.1.2. Resistência a condições ácidas e sais biliares
Para a triagem inicial de potenciais bactérias probióticas, testes in vitro são recomendados pela FAO/WHO [41].
As bactérias probióticas fornecidas por meio de sistemas alimentares devem primeiro sobreviver durante a passagem pelo trato gastrintestinal para, então, persistirem no intestino e promover efeitos benéficos ao hospedeiro. Para isso, devem apresentar como critérios funcionais: tolerância à acidez e a sais biliares e capacidade de adesão à mucosa intestinal. Adicionalmente, atividade antagonista é outro requisito fundamental para a sobrevivência no intestino [42, 43, 44].
3.1.3. Tolerância ao pH ácido
Antes das culturas probióticas serem capazes de exercer efeito no intestino, devem permanecer vivas durante a ingestão em ambientes agressivos do trato gastrintestinal, que inclui condições ácidas do estômago. A sobrevivência dos microrganismos no suco gástrico depende de sua capacidade de tolerar pH ácido. Nas Figuras que seguem (1, 2, 3, 4 e 5) estão apresentados o comportamento somente dos isolados que suportaram os tratamentos frente aos diferentes tempos e pHs.
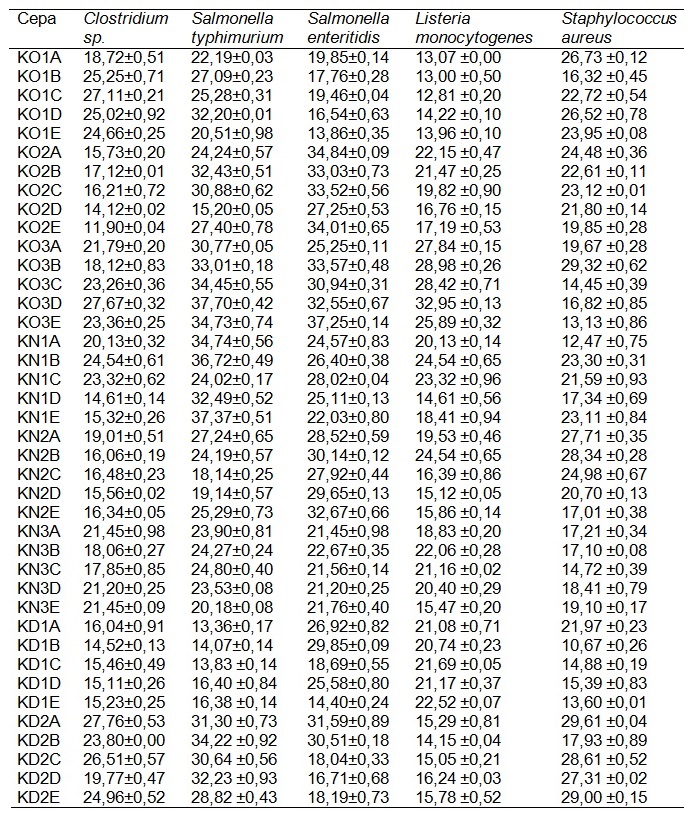
Valores expressos como médias e desvio padrão de triplicatas.
Tabela 1. Atividade antagonista de BALs nativas de kefir de produção artesanal da região Noroeste do RS, frente a patógenos de referência, com base na medida dos halos de inibição (mm).
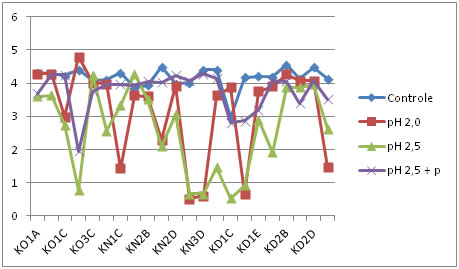
Controle: amostra sem tratamento. pH 2,5 + p: tratamento com pH 2,5 e enzima pepsina.
Figura 1. Comportamento dos isolados de BALs frente a condições ácidas no tempo zero (sem incubação).
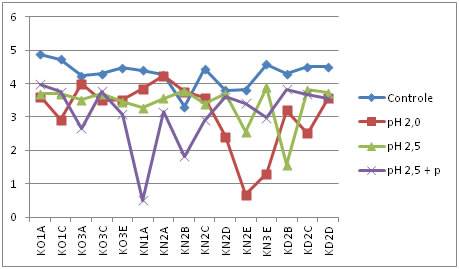
Controle: amostra sem tratamento. pH 2,5 + p: tratamento com pH 2,5 e enzima pepsina.
Figura 2. Comportamento dos isolados de BALs frente a condições ácidas no tempo um (após uma hora de incubação).
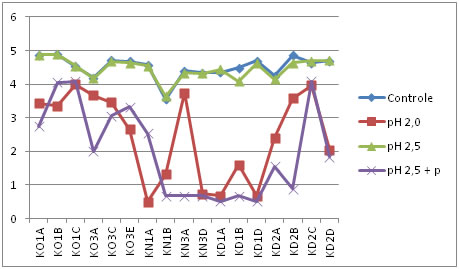
Controle: amostra sem tratamento.
pH 2,5 + p: tratamento com pH 2,5 e enzima pepsina.
Figura 3. Comportamento dos isolados de BALs frente a condições ácidas no tempo dois (após duas horas de incubação).
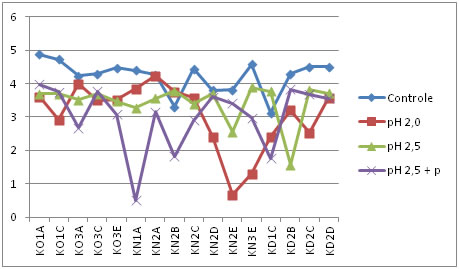
Controle: amostra sem tratamento. pH 2,5 + p: tratamento com pH 2,5 e enzima pepsina. Figura 4. Comportamento dos isolados de BALs frente a condições ácidas no tempo três (após três horas de incubação).
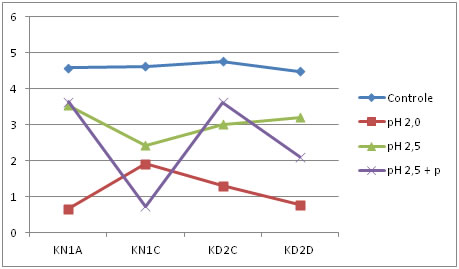
Controle: amostra sem tratamento. pH 2,5 + p: tratamento com pH 2,5 e enzima pepsina.
Figura 5. Comportamento dos isolados de BALs frente a condições ácidas no tempo quatro (após quatro horas de incubação).
Conforme as Figuras 1, 2, 3, 4 e 5, é possível observar que parte dos isolados avaliados apresentaram comportamento similar nos tratamentos, onde 4 deles resistiram em até 4 horas de exposição aos diferentes pHs ácidos. Isso indica que os isolados avaliados, foram capazes de suportar condições ácidas, o que é uma importante característica probiótica.
De acordo com Charteris et al. [45], o percentual de redução inferior a 30% da população inicial, torna-se condição essencial para classificação de um microrganismo como resistente às condições de estresseestomacal. Redondo [46], investigando características probióticas in vitro de E. faecium CRL 183, encontrou perda de viabilidade, deste isolado, de aproximadamente 20% ao final das 3 horas, similarmente ao comportamento obtido pelos isolados desse estudo.
A Tabela 2 apresenta a porcentagem de sobrevivência de 27 isolados que apresentaram-se mais viáveis ao longo dos testes. De acordo com os dados apresentados pode-se observar que houve maior taxa de sobrevivência nos pHs 2,5 e 2,5 com pepsina, onde de um total de 27 isolados, 44% sobreviveram em pH 2,5 e 40% em pH 2,5 com pepsina. Dados similares foram encontrados por Carasi et al. [47], onde ao submeterem seis isolados de bactérias ácido-láticas de kefir obtiveram 50% de sobrevivência nas mesmas condições de pH. Santos et al. [39] ao submeterem isolados de bactérias ácido-láticas de kefir ao pH 2,5 observaram que houve sobrevivência dos mesmos, porém sem apresentarem crescimento. Já Zatini et al. [48] ao aplicarem a mesma avaliação em 52 isolados de bactérias ácido-láticas de kefir em pH 2,5, obtiveram apenas 19% de sobrevivência dos mesmos.
3.1.4. Tolerância a sais biliares
Outra barreira que as bactérias probióticas devem transpor no organismo é a bile presente no intestino delgado, no qual o tempo de trânsito do alimento é geralmente entre 1 a 4 horas. Os sais biliares são os principais componentes da bile, capazes de desorganizar a estrutura de membranas celulares e, dessa forma, tóxicos às células vivas [49]. Na Tabela 4 é possível observar a tolerância dos isolados de BALs frente à bile bovina a 0,3% e 1,0%, após uma e quatro horas de incubação.
De acordo com os dados obtidos, verifica-se que os isolados avaliados quanto à resistência aos sais biliares obtiveram comportamento semelhante entre si, em relação à capacidade de sobrevivência a essas condições nos tempos avaliados. Estes resultados são promissores e demonstram o potencial de tais isolados serem utilizados como probióticos, já que a concentração de sais biliares entre 0,15% e 0,3% tem sido recomendada para a avaliação in vitro da passagem pelo intestino delgado [43, 50].
Na Tabela 3, é possível observar a contagem das BALs de 27 isolados selecionados frente aos diferentes tratamentos com bile bovina, onde apenas o isolado KN2D não sobreviveu aos tratamentos. No tratamento com bile a 0,3%, 48% do isolados, além de resistirem a essa condição, ainda apresentaram crescimento. Já no tratamento com 1% de bile bovina, 30% dos isolados apresentaram crescimento. Destaca-se o isolado KN2B que apresentou crescimento nos dois tratamentos, o que indica uma grande resistência a essas condições. Carasi et al. [47] ao submeterem 52 isolados de bactérias ácido-láticas de kefir ao teste de resistência à condições biliares, observaram 79% de sobrevivência das mesmas, resultado muito semelhante à Santos et al. [39], onde obtiveram 80% de sobrevivência ao submeterem 58 isolados de bactérias ácido-láticas de kefir aos mesmos tratamentos.
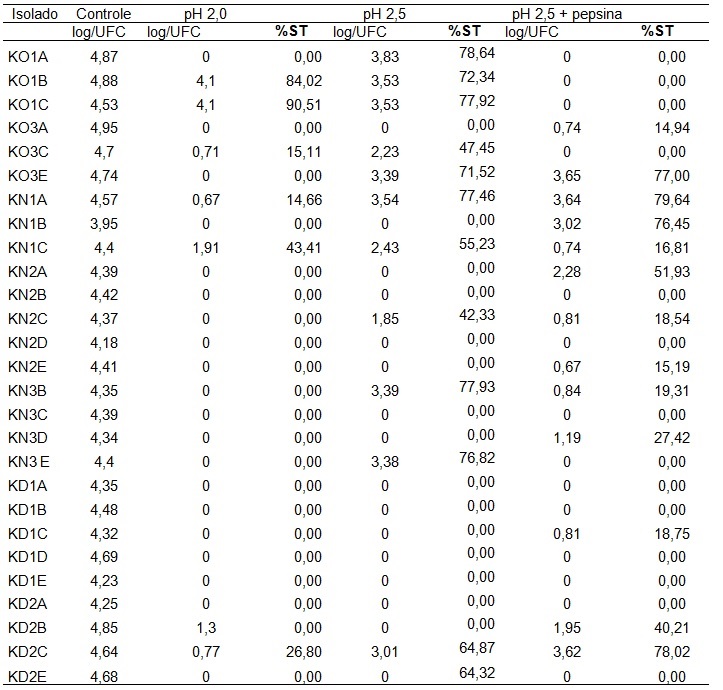
Tabela 2. Avaliação da sobrevivência total (%ST) de BALs frente a diferentes pHs, com base na contagem de células viáveis, após quatro horas de incubação.
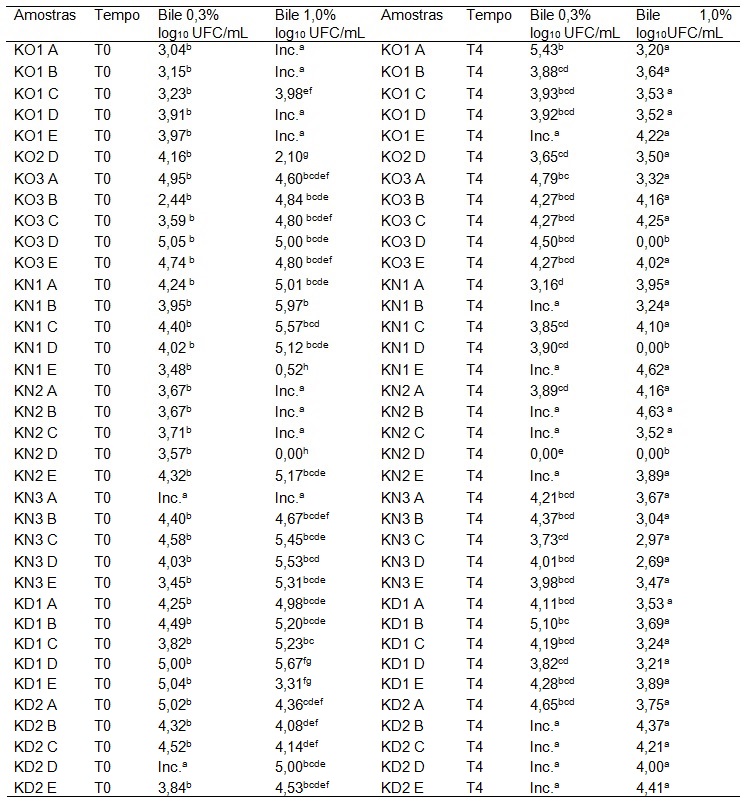
Valores de contagem de células viáveis expressos como médias de triplicatas (log10UFC/mL).
Médias seguidas de letras distintas, na coluna, diferem significativamente entre si pelo teste de Tukey a 5% de significância.
Tabela 3. Contagem de BALs nos tempos 1 (após 1 hora de incubação) e 4 (após quatro horas de incubação), sob exposição a sais biliares.
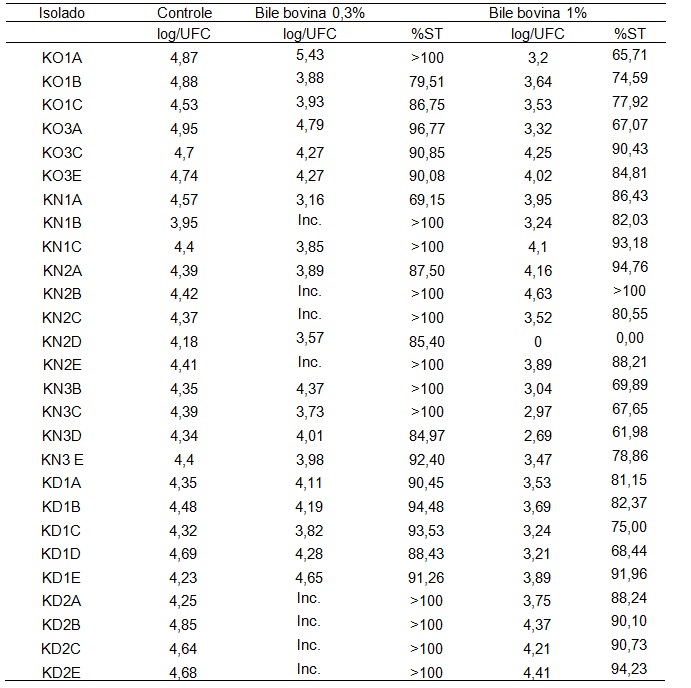
Tabela 4. Avaliação da sobrevivência total (%ST) de BALs frente a diferentes concentrações de bile, com base na contagem de células viáveis, após quatro horas de incubação.
4. Conclusões
Os isolados de bactérias ácido láticas avaliados nesse estudo apresentaram características fenotípicas idênticas, o que é um indicativo de que se trata de um mesmo grupo de microrganismos apresentando sobrevivência a condições extremas de estresse, como o sistema intestinal que tem como características o baixo pH e presença de sais biliares, além de apresentarem formação de halo de inibição frente a cepas de bactérias patogênicas, o que é uma importante potencialidade probiótica e torna esses isolados uma interessante fonte de estudos, para que posteriormente possam servir de cultura starter e serem introduzidos em produtos láteos.
Dos 40 isolados incialmente, apenas 27 sobreviveram até o final das avaliações, no entanto, todos possuem a propriedade de formar halos de inibição frente aos patógenos testados. Dos 27 isolados, 48% resistiram até os testes finais, além de sobreviverem ao tratamento de 0,3% de bile bovina, ainda apresentaram crescimento nessa condição, bem como 30% cresceram no tratamento com 1% de bile bovina. Já para a condição de pH ácido os mesmos 27 isolados, apresentaram pouca resistência ao tratamento com pH 2,0, onde apenas 6 isolados sobreviveram, porém 44% sobreviveram aos tratamentos em pH 2,5 e 2,5 com pepsina. Vale ressaltar que os isolados que não apresentaram condições favoráveis de desenvolvimento em pH ácido, bem como os isolados que apresentaram atividade antagônica à bactérias patogênicas, porém não sobreviveram até o final das avaliações, não devem ser descartados como potenciais probióticos, visto que podem ser inseridos em alimentos através de técnicas de proteção, como a microencapsulação. Mais estudos são necessários para a verificação dessa potencialidade probiótica.
5. Referências
[1] Nystrand B.T., Olsen S.O. Consumers’ attitudes and intentions toward consuming functional foods in Norway. Food Quality and Preference 2020; 80:103827, https://doi.org/10.1016/j.foodqual.2019.103827.
[2] Díaz L.D., Fernández-Ruiz V., Cámara M. An international regulatory review of food health-related claims in functional food products labeling. Journal of Functional Foods 2020; 68:103896, https://doi.org/10.1016/j.jff.2020.103896.
[3] Lenssen K.G.M., Bast A., Boer A. Clarifying the health claim assessment procedure of EFSA will benefit functional food innovation. Journal of Functional Foods 2018; 47:386-396. https://doi.org/10.1016/j.jff.2018.05.047.
[4] Hunter D.C., Jones V.S., Hedderley D.I., Jaeger S.R. The influence of claims of appetite control benefits in those trying to lose or maintain weight: The role of claim believability and attitudes to functional foods 2019; 119:715-724. https://doi.org/10.1016/j.foodres.2018.10.051.
[5] Venkatakrishann K., Chiu H.F., Wang C.K. Popular functional foods and herbs for the management of type-2-diabetes mellitus: A comprehensive review with special reference to clinical trials and its proposed mechanism. Journal of Functional Foods 2019; 57:425-438. https://doi.org/10.1016/j.jff.2019.04.039.
[6] Farag M.A., Abdelwareth A., Sallam I.E., Shorbagi M., Jehmlich N., Fritz-Wallace K., Schäpe S.S., Rolle-Kampczyk U., Ehrlich A., Wessjohann L.A., Bergen M. Metabolomics reveals impact of seven functional foods on metabolic pathways in a gut microbiota model. Journal of Advanced Research 2020; 23:47-59, https://doi.org/10.1016/j.jare.2020.01.001.
[7] Ashaolu T.J. Immune boosting functional foods and their mechanisms: A critical evaluation of probiotics and prebiotics. Biomedicine & Phamacotherapy 2020; 130:110625. https://doi.org/10.1016/j.biopha.2020.110625
[8] Kotilainen L., Rajalahti R., Ragasa C., Pehu, E. Health enhancing foods: Opportunities for strengthening the sector in developing countries. Agriculture and Rural Development Discussion 2006; 82p.
[9] Guzel-Seydim Z., Kok-Tas T., Grene A.K. Review: functional properties of kefir. Critical Reviews in Food Science and Nutrition 2011; 51(3): 261-268. https://doi.org/10.1080/10408390903579029.
[10] Leite A.M.O., Miguel M.A.L., Peixoto R.S., Rosado A.S., Silva J.T., Paschoalin V.M.F. Microbiological, technological and therapeutic properties of kefir: a natural probiotic beverage. Brazilian Journal of Microbiology 2013; 44: 341-349. https://doi.org/10.1590/S1517-83822013000200001
[11] Kolling F.F., Richards N.S.P.S. Kefir - um alimento milagroso? Food Ingredients 2004; 6(33):62-71.
[12] Koroleva N.S. Technology of kefir and kumys. IDF Bul 18; 227:96-100.
[13] Anselmo R.J., Vitoria S.S., Lausada, L. I. Effect of kefir bactericide on Salmonella spp. Informacion Tecnologica 2001; 12(5):91-95.
[14] Ribeiro A.S. Caracterização de mico-organismos com potencial probiótico isolados a partir de kefir produzido na região noroeste do estado do Rio Grande do Sul. Dissertação. Santa Maria: Universidade Federal de Santa Maria; 2015.
[15] Carneiro R.P. Desenvolvimento de uma cultura iniciadora para produção de kefir. Dissertação. Universidade Federal de Minas Gerais, Belo Horizonte, 2010.
[16] Ministério da Agricultura, Pecuária e Abastecimento. Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (RIISPOA). Brasil, 2017. Disponível em: http://www.agricultura.gov.br/noticias/diariooficial-publica-decreto-do-novo-regulamento-de-inspecao-industrial-e-sanitaria. Acesso em 13 Ago. 2017.
[17] Ministério da Agricultura, Pecuária e Abastecimento. Instrução Normativa nº 46, de 23 de outubro de 2007. Regulamento Técnico de Identidade e Qualidade de Leites Fermentados. Brasil, 2007. Disponível em: http://extranet.agricultura.gov.br/sislegis-consulta/ servlet/VisualizarAnexo?id=13515. Acesso em 13 Ago 2017.
[18] DUPONT. Kefir-D Cultures. Disponível em: https://www.dupontnutritionandbiosciences.com/products/kefir-d-cultures.html. Acesso em 13 de Ago. de 2020.
[19] Madera C., García P., Janzen T., Rodríguez A., Suárez J.E. Characterization of technologically proficient wild Lactococcus lactis strains resistant to phage infection. International Journal of Food Microbiology 2003; 86(3):213-222. https://doi.org/10.1016/S0168-1605(03)00042-4.
[20] Piard J.C., Desmazeaud M. Inhibiting factors produced by lactic acid bacteria. 2-Bacteriocins and other antimicrobial substance. Lait 1992; 72:113-142. https://doi.org/10.1051/lait:199229.
[21] Bengoa A.A., Iraporda C., Garrote G.L., Abraham A.G. Kefir micro- organisms: Their role in grain assembly and health properties of fermented milk. Journal of Applied Microbiology 2019; 126(3):686–700. https://doi.org/10.1111/jam.14107.
[22] Ferrocino I., Reale A, Sabbatini R, Milanovic V, Alkic-Subasic M, Boscaino F, Aquilanti L, Pasquini M, Trombetta M.F., Tavoletti S., Coppola R., Cocolin L., Blesic M., Saric Z., Clementi F., Osimani A. Study of kefir drinks produced by backslopping method using kefir grains from Bosnia and Herzegovina: Microbial dynamics and volatilome profile. Food Research International 2020; 137:1-15. https://doi.org/10.1016/j.foodres.2020.109369.
[23] Davras F., Guzel-Seydim Z. B., Tas T. K. Immunological effects of Kefir produced from Kefir grains versus starter cultures when fed to mice. Functional Foods in Health and Disease 2018; 8(8):412–423. https://doi.org/10.31989/ffhd.v8i8.533.
[24] Moreira M.E.C., Santos M.H., Marcelo H., Pereira I.O., Ferraz V., Barbosa L.C.A., Schneedorf J. Atividade anti-inflamatória de carboidrato produzido por fermentação aquosa de grãos de quefir. Química Nova 2008; 31(7). https://doi.org/10.1590/S0100-40422008000700027.
[25] Abriouel H., Franz C.M.A.P., Omar N.B., Gálvez A. Diversity and applications of Bacillus bacteriocinas. FEMS Microbiology Reviews 2011; 35:201-232. https://doi.org/10.1111/j.1574-6976.2010.00244.x
[26] Richards N.S.P.S. Novos produtos para a indústria de laticínios. In: Martins P.C., Piccinini G.A., Krug E.E.B., Martins C.E., Lopes F.C.F. (eds) Sustentabilidade ambiental, social e econômica da cadeia produtiva do leite. Brasília: EMBRAPA, 2015, p. 329-338. Brasília, Brasil.
[27] Delgado-Fernandez P., Corzo N., Lizasoain S., Olano A., Moreno F. J. Fermentative properties of starter culture during manufacture of kefir with new prebiotics derived from lactulose. International Dairy Journal 2019; 93:22–29. https://doi.org/10.1016/j.idairyj.2019.01.014.
[28] APHA. American Public Health Association. Compendium of methods for the microbiological examination of foods. Washington, 2002.
[29] Jacobsen C. N., Nielsen V.R., Hayford A.E., Mөller P.L., Michaelsen K.F., Pærregaard A., Sandström B., Tvede M., Jakobsen M. Strains in humans the colonization ability of five selected by in vitro techniques and evaluation of forty-seven strains of Lactobacillus spp. screening of probiotic activities of the colonization ability of five selected strains in humans. Applied Environmental Microbiology 1999; 65(11):4949-4956.
[30] Perelmuter K., Fraga M., Zunino P. In vitro activity of potential probiotic Lactobacillus murinus isolated from the dog. Journal of Applied Microbiology 2008; 104:1718- 1725. https://doi.org/10.1111/j.1365-2672.2007.03702.x.
[31] Moraes P.M., Perin L.M., Ortolani M.B.T., Yamazi, A.K., Viçosa G.N., Nero L.A. Protocols for the isolation and detection of lactic acid bacteria with bacteriocinogenic potential. LWT - Food Science and Technology 2010; 43:1320-1324. https://doi.org/10.1016/j.lwt. 2010.05.005.
[32] Santos G., Costa J.A.M., Cunha V.C.M., Barros M.O., Castro A.A. Avaliação sensorial, físico-química e microbiológica do leite fermentado probiótico desnatado adicionado de jenipapo desidratado osmoticamente. Revista do Instituto de Laticínios Cândido Tostes 2012; 67(388):61-67. https://doi.org/10.5935/2238-6416.20120066.
[33] Schillinger U., Lucke F.K. Antibacterial activity of Lactobacillus sake isolated from meat. Applied and Environmental Microbiology 1989; 55(8):1901-1906.
[34] Jones R.J., Hussein H.M., Zagorec M., Brightwell G., Tagg J.R. Isolation of lactic acid bacteria with inhibitory activity against pathogens and spoilage organisms associated with fresh meat. Food Microbiology 2008; 25:228–234. https://doi.org/10.1016/j.fm.2007 .11.001.
[35] Nero L.A., Mattos M.R. de, Barros M.A.F., Ortolani M.B.T., Beloti V., Franco B.D.G.M. Listeria monocytogenes and Salmonella spp. in raw milk produced in Brazil: occurrence and interference of indigenous microbiota in their isolation and development. Zoonoses Public. Health 2008; 55:299–305. https://doi.org/10.1111/j.1863-2378.2008.01130.x.
[36] Ortolani M.B.T. Bactérias ácido-láticas autóctones de leite cru e queijo minas frescal: Isolamento de culturas bactericinogênicas, caracterização da atividade antagonista e identificação molecular. 2009. Dissertação (Mestrado em Medicina Veterinária), Universidade Federal de Viçosa, Minas Gerais.
[37] Sawitzki M.C., Fiorentini A.M., Bertol T.M., Sant‘Anna E.S. Lactobacillus plantarum strains isolated from naturally fermented sausages and their technological properties for application as starter cultures. Ciência e Tecnologia de Alimentos 2009; 29(2):340-345. https://doi.org/10.1590/S0101-20612009000200016.
[38] Meira S.M.M., Helfer V.E., Medina L.F.C., Brandelli A. Atividade antagonística de Lactobacillus frente a bactérias de importância em alimentos. In: 3º Simpósio de Segurança Alimentar, 2010, Florianópolis. Anais do 3º Simpósio de Segurança Alimentar 2010. Florianópolis: SBCTA.
[39] Santos A., Mauro S., Sanchez A., Torres J.M., Marquina D. The Antimicrobial Properties of Different Strains of Lactobacillus spp. Isolated from Kefir. Systematic and Applied Microbiology 2003; 26:434–437. https://doi.org/10.1078/072320203322497464.
[40] Dias P.A. Atividade Antimicrobiana de Microrganismos Presentes em Grãos de Kefir. 2011. Dissertação (Programa de Pós Graduação em Veterinária) – Universidade Federal de Pelotas, Pelotas.
[41] FAO/WHO. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria. Joint Food and Agricultural Organization of the United Nations and World Health Organization Expert Consultation Report 2001, Córdoba, Argentina.
[42] Vinderola C.G., Reinheimer J.A. Lactic acid starter and probiotic bacteria: a comparative “in vitro” study of probiotic characteristics and biological barrier resistance. Food Research International 2003; 36:895–904. https://doi.org/10.1016/S0963-9969(03)00098-X.
[43] Huang Y., Adams, M.C. In vitro assessment of the upper gastrointestinal tolerance of potential probiotic dairy propionibacteria. International Journal of Food Microbiology 2004; 91:253– 260. https://doi.org/10.1016/j.ijfoodmicro.2003.07.001.
[44] Schillinger U., Guigas C., Holzapfel W.H. In vitro adherence and other properties of lactobacilli used in probiotic yoghurt-like products. International Dairy Journal 2005; 15(12):1289-1297. https://doi.org/10.1016/j.idairyj.2004.12.008.
[45] Charteris W.P., Kelly P.M., Morelli L., Collins J.K. Selective detection, enumeration and identification of potentially probiotic Lactobacillus and Bifidobacterium species in mixed bacterial populations. International Journal of Food Microbiolology 1997; 35:1-27. https://doi.org/10.1016/s0168-1605(96)01222-6.
[46] Redondo N.C. Avaliação in vitro de características probióticas do Enterococcus faecium CRL183 e do Lactobacillus helveticus sspjugurti. 2008. Dissertação. (Universidade Estadual Paulista “Júlio de Mesquita Filho”, Araraquara, Brasil). 109p.
[47] Carasi P., Jacquot C., Romanin D.E., Elie A., De Antoni G.L., Urdaci M.C., Serradell M.A. Safety and potential beneficial properties of Enterococcus strains isolated from kefir. International Dairy Journal 2014; 39:193-200. https://doi.org/10.1016/j.idairyj.2014.06.009.
[48] Zanirati D.F., Abatemarco M., Sandes S.H.C., Nicoli J.R., Nunes A.C., Neumann E. Selection of lactic acid bacteria from Brazilian kefir grains for potential use as starter or probiotic cultures. Anaerobe 2015; 32:70-76. https://doi.org/10.1016/j.anaerobe.2014.12.007.
[49] Begley M., Hill C., Gahan C.G.M. Bile Salt Hydrolase Activity in Probiotics. Applied and Environmental Microbiology 2006; 72(3):1729–1738. https://doi.org/10.1128/AEM.72.3.1729-1738.2006.
[50] Golowczyc M.A., Silva J., Teixeira P., De Antoni G., Abraham A.G. Cellular injuries of spray-dried Lactobacillus spp. Isolated from kefir and their impact on probiótica properties. International Journal of Food Microbiology 2011; 144:556-560. https://doi.org/10.1016/ j.ijfoodmicro.2010.11.005.
Autores
Alice de Souza Ribeiro1, Leidi Daiana Preichardt1, Neila Silvia Pereira dos Santos Richards2,*
1. Instituto Federal Farroupinha, Rua Fábio João Andolhe, 1100, 98590-000, Santo Augusto – RS, Brasil.
2. Departamento de Tecnologia e Ciência dos Alimentos, Universidade Federal de Santa Maria - DTCA/UFSM, Avenida Roraíma, 1000, Prédio 42, sala 3211, 97105-900, Santa Maria - RS, Brasil.
* Autor para correspondência:neilarichardsprof@gmail.com
